
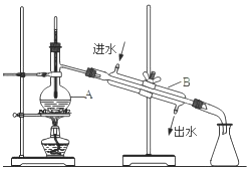
 如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.分析 实验室用自来水制取蒸馏水用蒸馏的方法制备,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用.
解答 解:(1)温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,
故答案为:温度计水银球应位于蒸馏烧瓶的支管处;冷凝管中冷凝水应低进高出;
(2)依据仪器形状可知:A 仪器的名称是蒸馏烧瓶,B 仪器的名称是冷凝管;
故答案为:蒸馏烧瓶;冷凝管;
(3)为防止液体暴沸,应加入碎瓷片;若蒸馏开始后发现忘记加入该物质,补救办法是冷却后补加;
故答案为:碎瓷片;防暴沸;冷却后补加;
点评 本题考查实验室制备蒸馏水操作,题目难度不大,本题注意实验操作要点,学习中注意正确操作方法和实验的注意事项.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
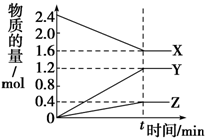 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 活性炭/mol | NO/mol | A/mol | B/mol | ρ/Mpa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 | ρ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
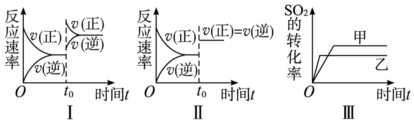
| A. | 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响 | |
| B. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低 | |
| C. | 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
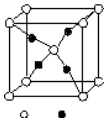 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com