
| 选项 | 事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可作为油脂分解的催化剂 |
| B | 铝罐车可用于运输稀硝酸 | 铝表面形成致密氧化膜具有保护作用 |
| C | 甘油作为化妆品中的保湿剂 | 甘油易与水形成氢键 |
| D | 氢氟酸刻蚀水晶工艺品 | HF具有强酸性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠水解显碱性,可促进油污的水解;
B.Al、氧化铝均与稀硝酸发生反应;
C.甘油中含3个-OH,易形成氢键;
D.HF为弱酸,可与二氧化硅反应.
解答 解:A.碳酸钠水解显碱性,可促进油污的水解,加热促进水解,则用热的纯碱溶液洗去油污,与催化剂无关,故A错误;
B.Al、氧化铝均与稀硝酸发生反应,则铝罐车不能用于运输稀硝酸,故B错误;
C.甘油中含3个-OH,易形成氢键,则甘油作为化妆品中的保湿剂,故C正确;
D.HF为弱酸,可与二氧化硅反应,则氢氟酸刻蚀水晶工艺品,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及盐类水解、氧化还原反应、物质的性质等,把握物质的性质、反应原理、性质与用途的关系为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
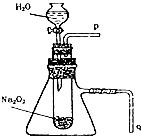 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
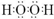 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)+c(NO3-)+c(OH-)=c(H+)+c(Na+) | |
| B. | c(CH3COO-)=c(Na+)=c(NO3-)>c(CH3COOH)>c(H+)>c(Na+) | |
| C. | c(CH3COO-)>c(NO3-)>c(CH3COOH)=c(Na+)>c(H+)>c(OH-) | |
| D. | c(Na+)>c(NO3-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
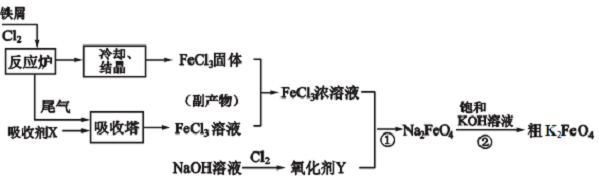
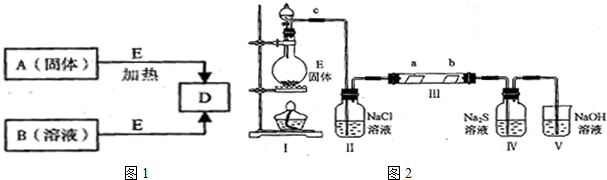
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知砷(As)元素的原子结构示意图为
已知砷(As)元素的原子结构示意图为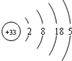
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、NH4+、SO42-、ClO- | |
| B. | KW/c(H+)=0.1 mol•L-1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 0.1 mol•L-1的Na2SO3溶液中:K+、H+、SO42-、NO3- | |
| D. | 澄清透明的溶液中:Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com