
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |


科目:高中化学 来源:不详 题型:单选题

A.在周期表中,族序数都等于该元素的最外层电子数. |
B.非金属性最强的元素,其氢化物溶于水的酸性最强 |
C.碱金属随原子序数增大,熔点降低;卤族元素的单质,随原子序数增大,熔点依次升高. |
| D.同一周期的主族元素,从左至右,原子半径减小,它们所形成的简单离子半径从左至右依次增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.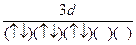 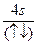 | B.(↑)(↑↓)(↑)(↑)(↑) (↑↓) |
| C.(↑↑)(↑)(↑)(↑)(↑) (↑↑) | D.(↓)(↓)(↓)(↓↑)(↓) (↑↓) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.RCl2 | B.R(OH)3 | C.RO2 | D.K2R2O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y是非金属元素 |
| B.若m>n,则Xax+的半径大于Za+的半径 |
| C.X、Y、Z三种元素位于周期表中的不同周期 |
D.若X、Y形成化合物的电子式X+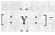 ,则原子序数:Y>Z>X ,则原子序数:Y>Z>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cs+、K+、Mg+、Al3+ | B.F、F―、Cl―、Br― |
| C.Ca2+、K+、Cl―、O2― | D.Al、Al3+、Mg、K |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HClO4、H2SO4、H3PO4的酸性依次增强 | B.HCl、HBr、HI的稳定性依次增强 |
| C.钠、镁、铝的还原性依次减弱 | D.N、O、F原子半径逐渐增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.XY2 | B.X2Y3 | C.X2Y | D.X3Y2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素的非金属性:X>Y>Z | B.原子序数:X>Y>Z |
| C.气态氢化物的稳定性:XH3>YH3>ZH3 | D.气态氢化物的还原性:XH3〈YH3〈ZH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com