
| A. | 伴有能量变化的物质变化,都是化学变化 | |
| B. | 干冰升华时,二氧化碳分子中的共价键不发生断裂 | |
| C. | 凡经加热而发生的化学反应都是吸热反应 | |
| D. | C(石墨,s)═C(金刚石,s),反应中既没有电子得失也没有能量变化 |
分析 A.物理变化时也可能伴随能量变化;
B.干冰升华时破坏分子间作用力;
C.放热反应也可能需要加热;
D.化学变化中一定伴随能量变化.
解答 解:A.物理变化时也可能伴随能量变化,如气态水液化会放出热量,所以伴有能量变化的物质变化不一定是化学变化,故A错误;
B.干冰晶体中分子间存在分子间作用力,干冰升华时破坏分子间作用力,共价键不发生断裂,故B正确;
C.放热反应也可能需要加热,如C在空气中燃烧属于放热反应,也需要加热,故C错误;
D.C(石墨,s)═C(金刚石,s),有新物质生成,属于化学变化,化学变化中一定伴随能量变化,故D错误.
故选B.
点评 本题考查了化学反应与能量变化、分子间作用力和共价键,题目难度不大,注意把握化学反应的两个特征:有新物质生成、伴随能量变化.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
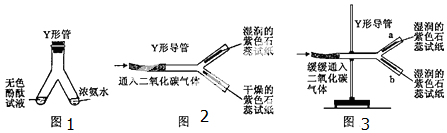
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C互称同位素,O2与O3是氧元素的同素异形体 | |
| B. | SO2和SO3属于酸性氧化物,Na2O和Na2O2属于碱性氧化物 | |
| C. | 潮解和电解属于化学变化,蒸馏和干馏属于物理变化 | |
| D. | 沼气和水煤气属于可再生能源,锌锰干电池和铅蓄电池属于二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
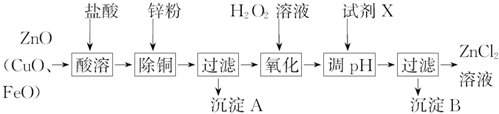
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 9.7 |
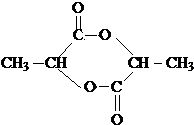 ,聚乳酸的结构简式为
,聚乳酸的结构简式为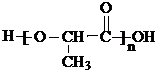 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol I2(s)升华,吸热17.00 kJ | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
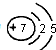 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
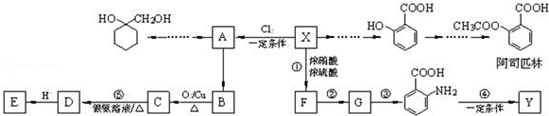
 $\stackrel{MnO(H)}{→}$
$\stackrel{MnO(H)}{→}$
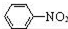 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$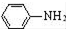 (苯胺,易被氧化)
(苯胺,易被氧化) .
.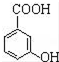 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: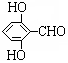 、
、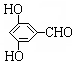 .
.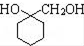 的流程图:
的流程图: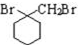 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$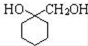
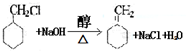 .
.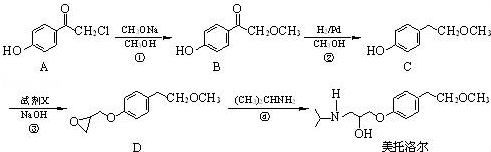
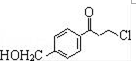 为原料制备
为原料制备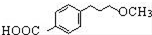 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com