
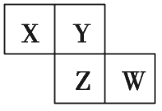
【题目】X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是( )
A. X、Y、Z的原子半径大小:X>Y>Z
B. Y、Z的气态氢化物中,前者更稳定
C. Z、W的最高价氧化物对应水化物的酸性,前者更强
D. X、W的气态氢化物相互反应,生成物中只含离子键不含共价键
【答案】B
【解析】
X、Y、Z、W均为短周期元素,由在周期表中位置可知,Y位于第二周期,Y原子的最外层电子数是电子层数的3倍,则Y的最外层电子数为6,可知Y为O,结合位置可知X为N,Z为S,W为Cl,A.同周期元素从左到右原子半径依次减小,同主族元素从上而下原子半径依次增大;B.非金属性越强,对于氢化物越稳定;C.非金属性越强,最高价氧化物对应水化物的酸性越强;D.X、W的气态氢化物相互反应生成氯化铵。
X、Y、Z、W均为短周期元素,由在周期表中位置可知,Y位于第二周期,Y原子的最外层电子数是电子层数的3倍,则Y的最外层电子数为6,可知Y为O,结合位置可知X为N,Z为S,W为Cl,A.同周期元素从左到右原子半径依次减小,同主族元素从上而下原子半径依次增大,X、Y、Z的原子半径大小:Z>X>Y,即S>N>O,选项A错误;B.非金属性Y>Z,则Y和Z的气态氢化物,前者更稳定,选项B正确;C.非金属性W>Z,最高价氧化物对应水化物的酸性为W>Z,选项C错误;D.X、W的气态氢化物相互反应生成氯化铵,含离子键和N-H共价键,选项D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法不正确的是
A. 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
B. 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管
C. Ni-Zn化合物的纳米颗粒可作![]() 反应的催化剂,提高苯的转化率
反应的催化剂,提高苯的转化率
D. 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们生活中处处都与化学有密切关系。
(1)洪灾过后,饮用水可用漂白粉消毒。
①工业上将氯气通入石灰乳 [Ca(OH)2]中制取漂白粉,反应的化学方程式为_______________________。
②Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为3Cl2(g)+8NH3(g)=6NH4Cl+N2(g),若反应中消耗Cl21.5mol,则被氧化的NH3的体积为_______________________L(标准状况)。
(2)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。
①电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:______________________________________________;如何检验FeCl3腐蚀铜后的溶液是否含Fe3+_______________________________________。
②高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
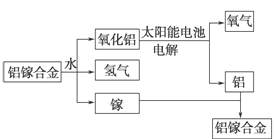
A. 该过程中,能量的转化形式只有两种
B. 铝镓合金可以循环使用
C. 铝镓合金与水反应的化学方程式为:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D. 总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
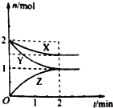
(1)n=______;
(2)Y的平衡浓度为_______;
(3)反应开始至平衡,X 的反应速率v(X)=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关金属及其化合物的用途正确的是( )
A.用铝制餐具做酸辣凉拌菜B.钢铁是我国发明使用最早的合金
C.氧化钠用于潜水艇中做供氧剂D.氧化铝是一种耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
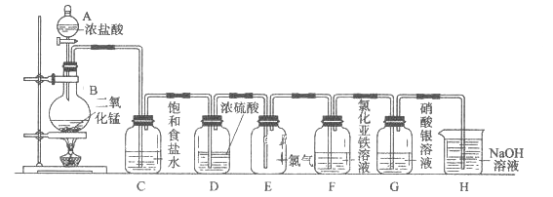
(1)A中盛有浓盐酸,B中盛有MnO![]() ,则烧瓶中发生反应的化学方程式为:______。
,则烧瓶中发生反应的化学方程式为:______。
(2)C中盛有饱和食盐水,其作用是_________,装置D的作用_________。
(3)装置E中气体的颜色为_______,E中Cl![]() 能使湿润的红色布条褪色的原因是________。
能使湿润的红色布条褪色的原因是________。
(4)F中是FeCl![]() 溶液,现象是________,发生反应的离子方程式为__________。
溶液,现象是________,发生反应的离子方程式为__________。
(5)G中是AgNO![]() 溶液,现象是___________,有关化学反应的离子方程式为_________。
溶液,现象是___________,有关化学反应的离子方程式为_________。
(6)H中盛有NaOH溶液,其作用是_______,发生反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
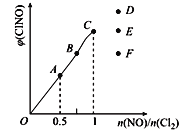
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
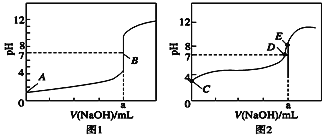
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com