
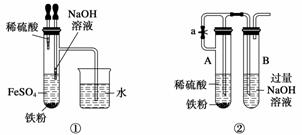
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
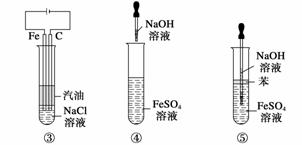
在阿斯匹林的结构简式(下图所示)中①②③④⑤⑥分别标出了其分子中的不同的键。
将阿斯匹林与足量NaOH溶液共煮时,发生反应时断键的位置是( )
A.①④
B.②⑤
C.②⑥
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 证明乙醇发生消去反应生成乙烯 | 将乙醇与浓硫酸混合加热到170℃,将产生的气体通入溴水 | 酒精灯、圆底烧瓶、导管、试管 |
| B | 证明HClO和CH3CO OH的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分 钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4·5H2O溶解在975g 水中 | 烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:
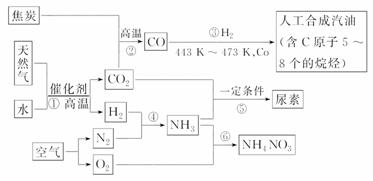
请回答下列问题:
(1)合成氨中原料气体N2来源于空气,可采用将空气________和________两种方法,H2可采用上述反应①,其化学方程式为____________________________________________。
(2)对于合成氨N2+3H2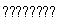 2NH3 ΔH<0,其中N2与H2体积比高于1∶3的原因是_______________________________;及时分离NH3的方法是_________________________。
2NH3 ΔH<0,其中N2与H2体积比高于1∶3的原因是_______________________________;及时分离NH3的方法是_________________________。
(3)制取NH4NO3时,NH3的用途有两种,制HNO3的量大于与HNO3反应的量的原因________________________________________________________________________。
(4)发生反应⑤的化学方程式为_____________________________________________。
(5)发生反应③生成C8H18的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(1)FeCl3蚀刻铜箔反应的离子方程式为_____________________________________
________________________________________________________________________。
(2)过程Ⅰ加入铁屑的主要作用是__________________________________________,
分离得到的固体主要成分是____ __________________________________________,
__________________________________________,
从固体中分离出铜需采用的方法是________________________________________。
(3)过程Ⅱ中发生反应的化学方程式为______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟 工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
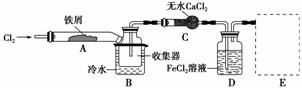
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用 干燥的N2赶尽Cl2,将收集器密封。
干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_______________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是__________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为______________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:_________________________________________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为_________________________________________
________________________________________________________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验 Ⅱ 的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②_________________________________________________ _______________________。
_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是[微软用户15]
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是[微软用户15]
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
D. 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com