
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。

请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为 。
(2)AB段曲线所表示的反应的离子方程式为 。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是 。
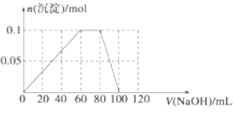
(4)向含有0.1mol NH4Al(SO4)2的溶液中逐滴加入5mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

【答案】
(1)1:3;(2)Al(OH)3+OH-=[Al(OH)4]-;
(3)生成白色沉淀
(4)
【解析】
试题分析:(1)分析图象可知,A点是氯化铝和氢氧化钠反应生成氢氧化铝和氯化钠的反应,反应的化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,A点时已参加反应的AlCl3和NaOH的物质的量之比为1:3,故答案为:1:3;
(2)AB段是氢氧化铝沉淀溶解的过程,反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)向B处生成的溶液中通入二氧化碳,可发生反应2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,反应生成白色沉淀,故答案为:生成白色沉淀;
(4)含有0.1mol NH4Al(SO4)2溶液中含有NH4+离子0.1mol,Al3+物质的量为0.1mol,逐滴加入5molL-1 NaOH溶液,发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3H2O,Al(OH)3+OH-=AlO2-+H2O,先生成氢氧化铝沉淀需要消耗氢氧化钠物质的量为0.3mol,体积=![]() =0.060L=60ml,和铵根离子反应消耗氢氧化钠物质的量为0.1mol,氢氧化钠溶液体积=
=0.060L=60ml,和铵根离子反应消耗氢氧化钠物质的量为0.1mol,氢氧化钠溶液体积=![]() =0.020L=20ml,生成氢氧化铝沉淀物质的量量为0.1mol,溶解需要氢氧化钠物质的量为0.1mol,消耗氢氧化钠溶液的体积为20ml,依据沉淀量和消耗氢氧化钠溶液体积描出图象为
=0.020L=20ml,生成氢氧化铝沉淀物质的量量为0.1mol,溶解需要氢氧化钠物质的量为0.1mol,消耗氢氧化钠溶液的体积为20ml,依据沉淀量和消耗氢氧化钠溶液体积描出图象为 ,故答案为:
,故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 金属元素的最外层电子数不一定小于4
B. 1A族元素形成的单质的熔点随原子序数的递增而降低
C. 同主族第三、第四周期的元素原子序数之差不一定等于18
D. 单质磷的化学性质比氮气活泼,容易与非金属等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+![]() H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+![]() O2(g)===H2O(g),反应过程中能量变化如下图,问:
O2(g)===H2O(g),反应过程中能量变化如下图,问:
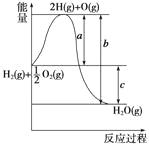
(1)a、b、c分别代表什么意义?
a______________;b____________;c__________。
(2)该反应是放热反应还是吸热反应?__________。ΔH大于零还是小于零?________
(3)若已知2H2(g)+O2(g)===2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH2=-Q2
则ΔH1______ΔH2,Q1______Q2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各情况中, Fe片被腐蚀的速率由快到慢的顺序是 (填字母)。
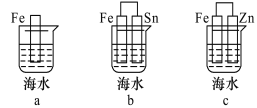
(2)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2 = 2H2O,完成下列问题:
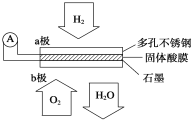
① 电子通过外电路从 极流向 极(填a或b)。
② b极上的电极反应式为: 。
③ 每转移0.1 mol电子,消耗H2的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在101 kPa时,足量H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为______,表示H2燃烧热的热化学方程式为___________________ 。
(2)1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为________,表示其中和热的热化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组通过实验探究Cu及其化合物的性质,操作正确且实验结论正确的是( )
A.常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液变为蓝色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.将CuCl2溶液在蒸发皿中加热蒸干,无法得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不能损伤铜器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在不同条件下的能量变化示意图如下,有关该图的说法正确的是

A.该反应是吸热反应
B.虚线代表的是使用了催化剂的反应图像,且降低了反应的活化能
C.两种条件下反应的热效应相同,且实线代表的反应速率较快
D.该反应的ΔH= E5-E1 = E4-E2 =E3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com