
| A. | 加热NH4HCO3 | B. | 煅烧海带 | C. | 熔化烧碱 | D. | 加热NaCl |
分析 氧化铝为两性氧化物,既能与酸反应又能与碱反应,故能与烧碱NaOH反应,则烧碱的熔化不能在氧化铝坩埚中进行,而氧化铝与NH4HCO3、NaCl和海带不反应,据此进行解答.
解答 解:A.加热分解NH4HCO3,NH4HCO3不与氧化铝反应,可以在在氧化铝坩埚中进行,故A不选;
B.海带不与氧化铝反应,可以在氧化铝坩埚中煅烧海带,故B不选;
C.烧碱为氢氧化钠,NaOH与氧化铝反应生成偏铝酸钠和水,所以不能在氧化铝坩埚中进行,故C选;
D.氯化钠与氧化铝不反应,可以在氧化铝坩埚中加热NaCl,故D不选;
故选C.
点评 本题考查了常见元素化合物的性质,题目难度不大,明确氧化铝的性质解答本题的关键,注意掌握常见元素及其化合物性质,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大反应容器体积 | |
| D. | Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中含有手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
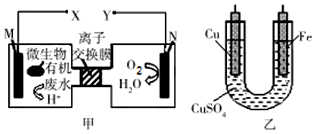
| A. | M电极反应式:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24nH+ | |
| B. | 铜电极应与X相连接 | |
| C. | 质子透过离子交换膜由右向左移动 | |
| D. | 当N电极消耗0.2 mol气体时,则铁电极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2>2 Q1 | B. | Q1=92.4 kJ | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列反应的离子方程式中,正确的是
A.稀硫酸滴在银片上 :2Ag + 2H+=2Ag+ + H2↑
:2Ag + 2H+=2Ag+ + H2↑
B.钠和冷水反应:Na+2H2O=Na++2OH?+H2↑
C.澄清石灰水与足量的碳酸氢钠溶液反应:Ca2+ + OH- + HCO3-=CaCO3↓ + H2O
D.氧化铁与稀盐酸 混合:Fe2O3 + 6H+=2Fe3+ + 3H2O
混合:Fe2O3 + 6H+=2Fe3+ + 3H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
和22gCO2所含分子数相等的水的质量为
A.44g B.9g C.18g D.22g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
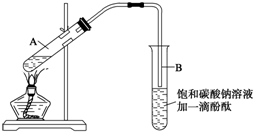 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com