

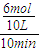 =0.06mol/L.min,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(H2)=0.18mol/L.min;
=0.06mol/L.min,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(H2)=0.18mol/L.min;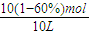 =0.4mol/L,C(H2)=
=0.4mol/L,C(H2)=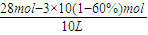 1mol/L,
1mol/L, =1.2mol/L,z则K=
=1.2mol/L,z则K=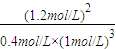 =3.6(mol/L) -2.
=3.6(mol/L) -2.

科目:高中化学 来源: 题型:
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
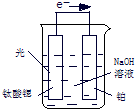 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
c(H2)c
| ||
| c(H2O) |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com