
分析 ①H++OH-=H2O表示强酸或者可溶性强酸的酸式盐和可溶性强碱;
②CaCO3+2H+═Ca2++CO2↑+H2O表示碳酸钙和可溶性强酸反应生成可溶性 盐和二氧化碳、水;
③向澄清石灰水中通入过量CO2,反应生成碳酸氢钙;
④原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水.
解答 解:①H++OH-=H2O表示强酸或者可溶性强酸的酸式盐和可溶性强碱,可表示盐酸与氢氧化钠反应,化学方程式:HCl+NaOH=NaCl+H2O;
故答案为:HCl+NaOH=NaCl+H2O;
②CaCO3+2H+═Ca2++CO2↑+H2O表示碳酸钙和可溶性强酸反应生成可溶性 盐和二氧化碳、水,可表示碳酸钙与盐酸反应,化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O;
③向澄清石灰水中通入过量CO2,反应生成碳酸氢钙,离子方程式:CO2+OH-=HCO3-;
故答案为:CO2+OH-=HCO3-;
④原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水,离子方程式为H++SO42-+OH-+Ba2+=BaSO4+H2O,
故答案为:H++SO42-+OH-+Ba2+=BaSO4+H2O;
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意反应物用量对反应的影响,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
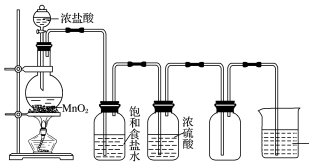
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
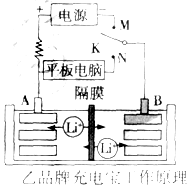 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol/L AlCl3溶液 | B. | 20 mL 0.1 mol/L CaCl2溶液 | ||
| C. | 30 mL 0.2 mol/L KCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com