
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() =1×10-12的溶液:Na+、K+、ClO-、CO32-
=1×10-12的溶液:Na+、K+、ClO-、CO32-
B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C. 能溶解Al(OH)3的溶液:K+、NH4+、NO3—、CH3COO—
D. 0.1mol/LFe(NO3)2溶液:H+、Cu2+、SO42—、Cl—
【答案】A
【解析】
A.已知![]() =
=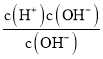 =c(H+)=1×10-12,溶液pH=12,显碱性,Na+、K+、ClO-、CO32-离子组碱性条件下彼此间不发生离子反应,能大量共存,故A正确;
=c(H+)=1×10-12,溶液pH=12,显碱性,Na+、K+、ClO-、CO32-离子组碱性条件下彼此间不发生离子反应,能大量共存,故A正确;
B.滴入酚酞变红色的溶液显碱性,而HCO3-在碱性溶液中不能大量共存,Ca2+和CO32-发生离子反应生成CaCO3溶液而不能大量共存,故B错误;
C.能溶解Al(OH)3的溶液可能显碱性,也可能是为酸性,NH4+在碱性溶液中不能大量共存,而CH3COO—在酸性溶液中不能大量共存,故C错误;
D.Fe2+在酸性条件下能被NO3-氧化,则0.1mol/LFe(NO3)2溶液中不可能大量存在H+,故D错误;
故答案为A。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:

(1)打开K2,闭合K1,若所盛溶液为CuSO4溶液:则A为________极,B极的电极反应式为__________。
(2)打开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是__________,总反应化学方程式是_________。
(3)如要用电解方法精炼粗铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Cu2+浓度_____(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)=4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol。下列叙述正确的是( )
A.容器中含D物质的量至少为0.45mol
B.A的平均反应速率是![]()
C.容器中A、B、C、D的物质的量之比一定是4:5:4:6
D.容器中A的物质的量一定增加了0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①He;②![]() ;③
;③![]() ;④CaO;⑤
;④CaO;⑤![]() ;⑥
;⑥![]() ;⑦
;⑦![]() ;⑧
;⑧![]() ;⑨KOH; 请用序号填空:
;⑨KOH; 请用序号填空:
(1)只含离子键的物质是______________;
(2)既含离子键又含共价键的物质是____;
(3)只含极性键的物质是______________;
(4)属于共价化合物的是______________;
(5)既含离子键又含非极性键的物质是______ ;
(6)不存在化学键的物质是__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
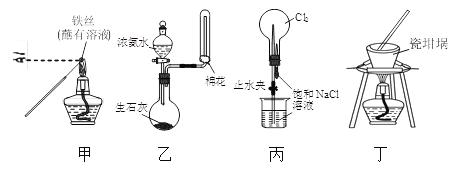
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 适当提高氧气的浓度
C. 适当提高反应的温度 D. 适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
请填写表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化 | |
拆开化学键 |
| ______ | ____ |
| ______ | ____ | |
形成化学键 |
| ______ | ____ |
总能量变化 | ______ | ____ | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为MnO2+H2SO3=MnSO4+H2O。下列说法错误的是( )
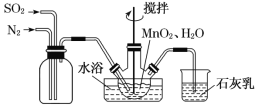
A. 若实验中将N2换成空气,则反应液中 的浓度之比变大
的浓度之比变大
B. 缓慢通入混合气体可提高SO2的转化率
C. 若不通N2,则烧瓶中的进气管口容易被堵塞
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com