
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
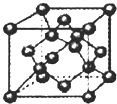 常见元素A、B、C、D,其原子结构的相关信息如下表:
常见元素A、B、C、D,其原子结构的相关信息如下表:| 元素 | 相关信息 |
| A | 核外电子总数等于该基态原子电子层数 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 基态原子L电子层中有3个未成对电子 |
| D | 生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质 |
| E | 外围电子排布为(n+1)d3n(n+2)sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①溶液中:c(CO32-)>c(H2CO3) |
| B、溶液中阴离子的物质的量浓度之和:②>① |
| C、溶液中水电离出的H+个数:②>① |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com