
下列各反应,反应物中的有机物发生还原反应的是____ _______________,发生氧化反应的是________________________。(填写序号)
①由乙醇制取乙醛 ②由乙醛制取乙醇
③乙醛的银镜反应 ④甲醛与新制的氢氧化铜反应
⑤苯与氢气的加成 ⑥乙炔使酸性高锰酸钾溶液褪色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012届陕西省西工大附中高三第11次模拟考试理综化学试卷(带解析) 题型:填空题
(15分)已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。
(I)写出A的电子式 。
(II)若反应①除生成甲外还生成丙,写出反应①的化学方程式: 。
(III)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以发生反应④生成甲和另一化合物X。回答下列各小题:
2.写出反应④的离子方程式 。
3.在恒容密闭容器中,反应②达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度℃ | 初始C浓度 (mol·L—1) | 初始丙浓度(mol·L—1) | C的平衡转化率 |
| 1 | 510 | 0.8 | 1.2 | A |
| 2 | 510 | 1 | 1.2 | 50% |
| 3 | 500 | 1 | 1.2 | B |
查看答案和解析>>
科目:高中化学 来源:09-10年福州格致中学高二下学期第三学段质量检查化学卷 题型:填空题
(6分)下列各反应,反应物中的有机物发生还原反应的是____ _______________,发生氧化反应的是________________________。(填写序号)
①由乙醇制取乙醛 ②由乙醛制取乙醇
③乙醛的银镜反应 ④甲醛与新制的氢氧化铜反应
⑤苯与氢气的加成 ⑥乙炔使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
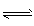 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。 
 CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题:
CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题: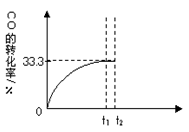
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com