
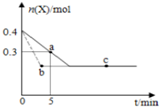
 �ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������
�ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������| A�� | ʵ�߱�ʾʹ�ô��������� | |
| B�� | b��c���������Ӧ����Ӧ�����´ﵽ������� | |
| C�� | ��Ӧ�ӿ�ʼ��a���ƽ����Ӧ���ʿɱ�ʾΪv��Y��=0.01mol/��L•min�� | |
| D�� | ��Ӧ���е�a��ʱ�ų����������ڷ�Ӧ���е�b��ʱ�ų������� |
���� A�������ӿ췴Ӧ���ʣ����ı�ƽ��״̬��
B��b��c����ʱ���ʵ������䣬���ﵽƽ��״̬��
C�����v=$\frac{��c}{��t}$���㣻
D��a��δ�ﵽƽ�⣬b��ﵽƽ�⣬b��ת����X�࣬�����ʵ��������������ȣ�
��� �⣺A�������ӿ췴Ӧ���ʣ����ı�ƽ��״̬����ͼ������ʱ���٣����߱�ʾʹ�ô��������Σ���A����
B��b��c����ʱ���ʵ������䣬���ﵽƽ��״̬����b��c���������Ӧ����Ӧ�����´ﵽ������ȣ���B��ȷ��
C����ͼ��֪��Ӧ�ӿ�ʼ��a���ƽ����Ӧ���ʿɱ�ʾΪv��X��=$\frac{\frac{0.4mol-0.3mol}{2L}}{5min}$=0.01mol/��L•min����������֮�ȵ��ڻ�ѧ������֮�ȿ�֪��v��Y��=0.01mol/��L•min����$\frac{1}{2}$=0.005mol/��L•min������C����
D��a��δ�ﵽƽ�⣬b��ﵽƽ�⣬b��ת����X�࣬�����ʵ��������������ȣ���Ӧ���е�a��ʱ�ų�������С�ڷ�Ӧ���е�b��ʱ�ų�����������D����
��ѡB��
���� ���⿼�����ʵ�����ʱ��ı仯���ߣ�Ϊ��Ƶ���㣬����ͼ�����ʵ����ı仯��ƽ��״̬�жϡ����ʼ���Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ͼ����ƽ���ƶ��Ľ�ϣ���Ŀ�ѶȲ���


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| T��K�� | 938 | 1100 |
| K | 0.68 | 0.40 |
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ϳɰ���Ӧ��ʹ�ô�����˵���������Դٽ���ƽ�������ɰ��ķ����ƶ� | |
| B�� | �����£�������ˮ����ϡ�ʹ��ᣬ��Һ��$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��}$��ֵ��С | |
| C�� | ��ӦSiO2��s��+3C��s��=SiC��s��+2CO��g�������²����Է����У���÷�Ӧ�ġ�H��0 | |
| D�� | ����Ca��OH��2�ij����ܽ�ƽ�⣬�����¶ȣ�Ca��OH��2���ܽ���������Ksp��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
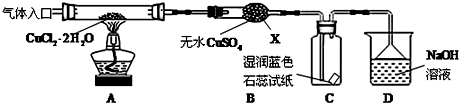
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
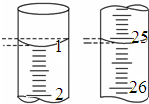 ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհף�
ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհף�| �ζ����� | ����NaOH��Һ�����/mL | 0.100 0mol/L��������/mL | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
| ��һ�� | 25.00 | 0.10 | 26.11 | 26.01 |
| �ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
| ������ | 25.00 | 0.32 | 26.31 | 25.99 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
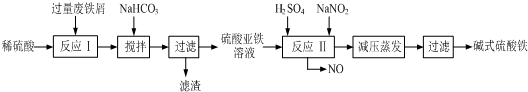
| ������ | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 |
| ��ȫ���� | 3.2 | 9.7 | 4.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.40mol | B�� | ��0.20mol | ||
| C�� | ����0.20mol | D�� | ��0.40mol������0.20mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com