
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | W元素的晶体单质是一种良好的半导体材料 | |
| C. | X分别与Y,Z,M,W形成的常见化合物中,稳定性最好的是XM | |
| D. | 化合物乙中一定只有共价键 |
分析 X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;W原子核外电子数是M原子最外层电子数的2倍,则最外层有4个电子,所以W为Si元素;Y、Z、M同周期且相邻,而Z与其同主族的短周期元素可形成常见气体甲,则Z为O元素,可推知Y为N元素、M为F元素,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等.结合对应的单质、化合物的性质以及元素周期律知识解答该题.
解答 解:X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;W原子核外电子数是M原子最外层电子数的2倍,则最外层有4个电子,所以W为Si元素;Y、Z、M同周期且相邻,而Z与其同主族的短周期元素可形成常见气体甲,则Z为O元素,可推知Y为N元素、M为F元素,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等,
A.气体甲为二氧化硫,二氧化硫与H2O2反应生成硫酸,故A正确;
B.W为Si元素,其单质可在电子工业用于生产半导体材料,故B正确;
C.X为H元素、Z为O元素、Y为N元素、M为F元素,非金属性F最强,故氢化物中HF最稳定,故C正确;
D.化合物乙若为NH4NO3,属于离子晶体,含有离子键、共价键,故D错误;
故选D.
点评 本题考查了元素的位置、结构和性质的关系,题目难度不大,能根据题意正确判断元素是解本题的关键,要注意把握对应单质和化合物的性质.


科目:高中化学 来源: 题型:选择题
| A. | 将氨水逐滴滴入Al2(SO4)3溶液中,直至过量 | |
| B. | 在AlCl3溶液中逐滴滴入NaOH溶液,直至过量 | |
| C. | 在NaOH 溶液中逐滴滴入 MgSO4 溶液,直至过量 | |
| D. | 在 Na2SiO3溶液中逐滴滴入盐酸,直至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
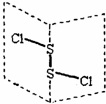 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是( )| A. | S2Cl2的结构式为 Cl-S-S-Cl | |
| B. | S2Cl2与水反应时只有S-Cl断裂 | |
| C. | S2Br2含有极性键和非极性键 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:b>a>c>d | B. | 原子半径:C>D>A>B | ||
| C. | 离子半径:Cn->D(n+1)->An+>B(n+1)+ | D. | 单质还原性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:131 53I | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 一个D2O分子所含的中子数为8 | |
| D. | N2的电子式:N:::N: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
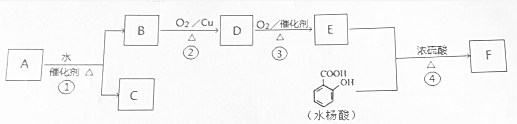
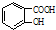 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$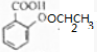 +H2O.
+H2O. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$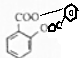 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B可能是同分异构体 | |
| B. | A和B不一定是同系物 | |
| C. | A和B完全燃烧后生成的水的质量相等 | |
| D. | A和B含碳的质量分数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com