
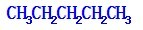 、
、 、
、 .
. 分析 (1)元素:核电荷数相同的一类原子的总称;
核素:具有一定数目质子和一定数目中子的原子;
中子数=质量数-质子数,依此进行判断;
(2)利用减链法书写同分异构体.
解答 解:(1)在${\;}_1^1$H,${\;}_1^2$H,${\;}_1^3$H,${\;}_{12}^{23}$Mg,${\;}_{12}^{24}$Mg,${\;}_8^{16}$O,${\;}_8^{17}$O,${\;}_8^{18}$O中共有共有氢、镁、氧3种元素,8种原子,
${\;}_1^1$HH的中子数为1-1=0,${\;}_1^2$H的中子数为2-1=1,${\;}_1^3$H的中子数为3-1=2,${\;}_{12}^{23}$Mg的中子数为23-12=11,${\;}_{12}^{24}$Mg的中子数为24-12=12,${\;}_8^{16}$O的中子数为16-8=8,${\;}_8^{17}$O的中子数为17-8=9,${\;}_8^{18}$O的中子数为18-8=10,故中子数最多的是${\;}_{12}^{24}$Mg;D218O的相对分子质量是2×2+18=22.
故答案为:3;8;${\;}_{12}^{24}$Mg;22;
(2)戊烷的三种同分异构体分别为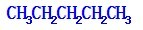 ,拿下1个碳原子作为支链为
,拿下1个碳原子作为支链为 ,拿下2个碳原子作为支链为
,拿下2个碳原子作为支链为 ,
,
故答案为: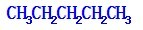 ;
; ;
; .
.
点评 本题考查元素、核素的概念、粒子间的数量关系计算、相对分子质量的相关计算以及同分异构体的书写等,难度不大,要注意基础知识的积累.


科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的次外层电子数都是2 | |
| B. | 稀有气体原子的最外层电子数均为8 | |
| C. | 原子的最外层电子数不超过8个 | |
| D. | 所有的原子核都是由质子和中子组成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  聚乙烯盒 |  |
| 成分 | (NH4)2SO4 | Na2CO3 |  | Fe2O3 |
| 用途 | 化肥 | 制玻璃 | 盛放食品 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com