
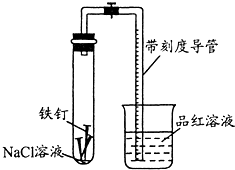
 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.| pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
| 液柱高度 | 0cm | 1.3cm | 8.5cm | 8.4cm | 8.5cm | 8.5cm |
| 形成稳定液柱时间 | 3.0min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | 17.5 min |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:实验题
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
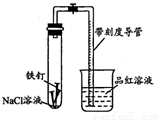
(1)实验前用碱液清洗铁钉,再用0.100mol/L的H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_____ 。
(2)为尽量减小误差,下列操作的正确顺序是______ (填序号)。
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为__ ____ ;用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,②___ ___ 。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH不同
假设二: NaCl溶液的浓度不同
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:

①当pH=2时,没有观察到稳定液柱形成的原因是__ ____
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:___________ ;
第二步::相同温度下,加入系统表面积的铁钉,组装两套完全相同的上述装置,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com