
| A. | 18.4 | B. | 18.4mol/L | C. | 1.84mol/L | D. | 无法计算 |
科目:高中化学 来源: 题型:解答题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、负极均可为惰性电极 | |
| B. | 正极的电极反应式均为O2+2H20+4e-=40H- | |
| C. | 正极通入的气体必须为纯氧气 | |
| D. | 1mol上述燃料完全放电,转移的电子数均为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
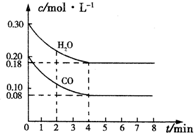 (1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,
(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,| t/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s末用物质A表示的反应速率为0.3mol/(L•s) | |
| B. | 2s内用物质B表示的反应速率为0.15mol/(L•s) | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的浓度为1.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物不一定能与水反应生成对应的酸,与水反应生成酸的氧化物不一定是酸性氧化物 | |
| B. | 碱性氧化物不一定能与水反应生成对应的碱,与水反应生成碱的氧化物不一定是碱性氧化物 | |
| C. | SO2、Na2O的水溶液都能导电,所以它们都是电解质 | |
| D. | 在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有A、B两个完全相同的装置,某学生在A的侧管中装入0.01mol Na2CO3,在B的侧管中装入0.01mol NaHCO3,并且A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
有A、B两个完全相同的装置,某学生在A的侧管中装入0.01mol Na2CO3,在B的侧管中装入0.01mol NaHCO3,并且A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L | |
| D. | 最终两试管中Na+、Cl-的物质的量一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com