
|
向硫酸铜溶液中加入一小块金属钠后,观察到的现象有 ①钠浮于液面上; ②熔化成小球; ③发出嘶嘶的响声,放出气体; ④钠周围蓝色沉淀部分变黑; ⑤有蓝色沉淀产生; ⑥析出大量红色的铜; ⑦小球在溶液中沉浮; ⑧小球在液面上游动、逐渐变小,直至消失. | |
| [ ] | |
A. |
①②③④⑤⑥ |
B. |
①②③④⑤⑧ |
C. |
①②③⑥⑧ |
D. |
②⑥⑦ |
科目:高中化学 来源: 题型:阅读理解
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
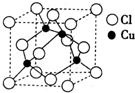 (2012?淄博一模)金属铜的导电性仅次于银,大量用于电气工业.
(2012?淄博一模)金属铜的导电性仅次于银,大量用于电气工业.查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.等物质的量的 Ba (OH )2与 NH4HSO4的稀溶液反应
Ba2+ + 2OH一+ 2H+ + SO42-=BaSO4↓+2H2O
B.向硫酸铜溶液中加入足量的氢氧化钡溶液 Ba2+十SO42-=BaSO4↓
C.向碳酸氢钠洛液中滴入过量石灰水 HCO3-+Ca2+十OH-=CaCO3↓+H2O
D.向氯化铝溶液中加入过量的氨水 A13++ 4NH3·H2O=Al(OH)3↓+4NH4+ +2H2O
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com