

分析 (1)电解水的装置中,氢氧根离子在阳极放电;
(2)原电池中正极发生还原反应,阴离子向负极移动;
(3)根据转移电子守恒:2Zn~~O2~~~2H2.
解答 解:(1)电解水的装置中,氢氧根离子在阳极放电,所以产生氧气的电极是B,故答案为:B;
(2)原电池中正极是氧气发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,该电池放电时溶液中的NO3-向负极移动,故答案为:O2+4e-+2H2O=4OH-;负;
(3)根据转移电子守恒:2Zn~~O2~~~2H2
65×2g 44.8L
0.13g V(H2)
$\frac{65×2g}{0.13g}=\frac{44.8L}{V({H}_{2})}$
解之得:V(H2)=44.8mL,
故答案为:44.8.
点评 本题考查电化学知识,理解这类题的关键是理解原电池原理,注意教材知识的灵活运用是解题的关键,难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:解答题
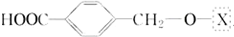 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备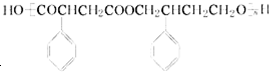 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 记载中的反应属于置换反应 | B. | CuSO4溶液呈中性 | ||
| C. | 记载中L含了湿法炼铜的原理 | D. | 每生成1mol铜转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 铜与稀硫酸反应:Cu+2H+=Cu2++H2↑ | |
| C. | 碳酸钙与稀盐酸反应:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com