
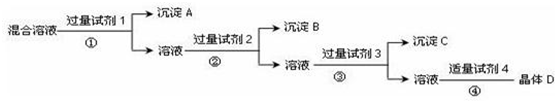
分析 实现Cl-、SO42-、NO3-的相互分离,通常用AgNO3沉淀Cl-,用BaCl2或Ba (NO3)2 沉淀SO42-,如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2或Ba (NO3)2 即试剂1,生成BaSO4沉淀即A,然后在滤液中加入过量的AgNO3即试剂2,使Cl-全部转化为AgCl沉淀即B,在所得滤液中加入过量的Na2CO3即试剂3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3即试剂4,最后进行蒸发操作可得固体NaNO3,以此分析解答.
解答 解:实现Cl-、SO42-、NO3-的相互分离,通常用AgNO3沉淀Cl-,用BaCl2或Ba (NO3)2 沉淀SO42-,如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2或Ba (NO3)2 即试剂1,生成BaSO4沉淀即A,然后在滤液中加入过量的AgNO3即试剂2,使Cl-全部转化为AgCl沉淀即B,在所得滤液中加入过量的Na2CO3即试剂3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3即试剂4,最后进行蒸发操作可得固体NaNO3,
(1)根据上面的分析可知,试剂1为BaCl2或Ba (NO3)2,试剂2为AgNO3,试剂3为Na2CO3,
故答案为:BaCl2或Ba (NO3)2;AgNO3;Na2CO3;
(2)加入过量的Ba(NO3)2,在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应后溶液中存在过量的Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,
故答案为:除去溶液中过量的Ag+、Ba2+;
(3)根据以上分析,操作①的名称是过滤,
故答案为:过滤;
(4)硝酸的量不可加入太多,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,发生:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,可通过测定溶液PH的方法判断反应是否已经完全,加入试剂4后发生反应的化学方程式为Na2CO3+2HNO3=CO2↑+H2O+2NaNO3,
故答案为:测定溶液pH;Na2CO3+2HNO3=CO2↑+H2O+2NaNO3.
点评 本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 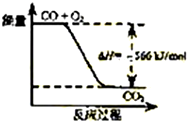 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤⑦ | C. | ②④⑥⑦ | D. | ①⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 | |
| D. | 2V正(CrO42-)=V逆(Cr2O72-)时,反应处于平衡态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应,产生22.4 L氢气 | |
| C. | 配制20 mL 4.6 mol/L的稀硫酸需用量筒取该硫酸5.00 mL | |
| D. | 该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2Al+2NaOH+2H2O═2NaAlO2+3H2反应中,水和氢氧化钠均作氧化剂 | |
| B. | Al分别于盐酸和氢氧化钠溶液反应,生成等质量的H2,转移的电子数相同 | |
| C. | CO2与Na2O2反应中,每生成1molO2,转移4mol电子 | |
| D. | 在Cu2S+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+S↓+SO2↑+4H2O反应中,被氧化的元素只有硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com