
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
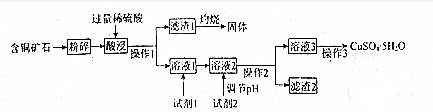
分析 某含铜矿石【主要成分xCuCO3•yCu(OH)2•zCuSiO3,含少量SiO3,FeCO3】粉碎后加入过滤稀硫酸酸浸过滤得到滤渣1和溶液1,其中滤渣1硅酸、二氧化硅,灼烧得到二氧化硅,溶液1中的亚铁离子需要加入氧化剂氧化亚铁离子为铁离子,选择价钱较低的漂液,利用NaClO氧化亚铁离子,溶液2中加入试剂2调节溶液PH,但不能引入新的杂质,操作2过滤得到滤渣2和溶液3,溶液中为硫酸铜溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥洗涤得到硫酸铜晶体,
(1)含铜矿石粉碎是增大接触面积加快反应速率,滤渣1为二氧化硅,依据二氧化硅的性质和用途分析;
(2)操作Ⅰ是过滤操作,依据过滤操作选择需要的仪器;
(3)选择价钱较低的漂液,利用NaClO氧化亚铁离子,反应为亚铁离子被次氯酸根离子在酸溶液中氧化生成铁离子;
(4)需调节溶液的pH的合理范围是保证铁离子全部沉淀,铜离子不沉淀,据此选择调节的溶液PH范围,试剂2和酸反应但不能引入新的杂质;
(5)溶液中得到溶质晶体的方法是通过蒸发浓缩、冷却结晶、过滤洗涤、干燥洗涤得到硫酸铜晶体,洗涤沉淀在过滤器中洗涤;
(6)由图可知,C(H+)=1×10-5mol•L-1,C(Cu2+)=1×10-2mol•L-1,根据KSP(Cu( OH )2)=C(Cu2+)×C2(OH-)来解答;
解答 解:某含铜矿石【主要成分xCuCO3•yCu(OH)2•zCuSiO3,含少量SiO3,FeCO3】粉碎后加入过滤稀硫酸酸浸过滤得到滤渣1和溶液1,其中滤渣1硅酸、二氧化硅,灼烧得到二氧化硅,溶液1中的亚铁离子需要加入氧化剂氧化亚铁离子为铁离子,选择价钱较低的漂液,利用NaClO氧化亚铁离子,溶液2中加入试剂2调节溶液PH,但不能引入新的杂质,操作2过滤得到滤渣2和溶液3,溶液中为硫酸铜溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥洗涤得到硫酸铜晶体,
(1)含铜矿石粉碎是增大接触面积加快反应速率,增大矿石与稀硫酸的接触面积,加快酸浸速率并使酸浸更充分,滤渣1为二氧化硅,依据二氧化硅的性质和用途分析,二氧化硅可以制备光导纤维、制备玻璃、生产硅单质等,
故答案为:增大矿石与稀硫酸的接触面积,加快酸浸速率并使酸浸更充分;制备光导纤维、制备玻璃、生产硅单质等;
(2)操作Ⅰ是过滤操作,依据过滤操作选择需要的玻璃仪器为漏斗、烧杯、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
(3)试剂价格:漂液(含25.2%NaClO)450元/吨,双氧水(含30%H2O2)2400元/吨,选择价钱较低的漂液,利用NaClO氧化亚铁离子,节约成本,反应为亚铁离子被次氯酸根离子在酸溶液中氧化生成铁离子,反应的离子方程式为:ClO-+2Fe2++2H+=Cl-+2Fe3++H2O,
故答案为:漂液;节约成本;ClO-+2Fe2++2H+=Cl-+2Fe3++H2O;
(4)需调节溶液的pH的合理范围是保证铁离子全部沉淀,铜离子不沉淀,据此选择调节的溶液PH范围,试剂2和酸反应但不能引入新的杂质,选择B.CuO C.Cu(OH)2,A选项Cu不能和稀酸反应不能调节溶液PH,D选项Fe会引入亚铁离子杂质,所以也就图表数据分析可知需调节溶液的pH的合理范围为为:3.7≤PH<4.0,
故答案为:3.7≤PH<4.0;BC;
(5)溶液中得到溶质晶体的方法是通过蒸发浓缩、冷却结晶、过滤洗涤、干燥洗涤得到硫酸铜晶体,洗涤沉淀在过滤器中洗涤,洗涤的方法为:用玻璃棒引流向过滤器中加入冷水至浸没沉淀,待水自然流下,重复2-3次,
故答案为:冷却结晶、过滤;用玻璃棒引流向过滤器中加入冷水至浸没沉淀,待水自然流下,重复2-3次;
(6)由图可知,C(H+)=1×10-6.5mol•L-1,C(Cu2+)=1×10-3mol•L-1,
根据KSP(Cu( OH )2)=C(Cu2+)×C2(OH-)=1×10-5×($\frac{1{0}^{-14}}{1{0}^{-6.5}}$)2=1.0×10-20,
故答案为:1.0×10-20;
点评 本题考查了物质的分离提纯过程、氧化还原反应、溶度积的计算等知识点,题目难度中等,解答本题的关键是认真审题,分析流程判断产物,掌握基础是解题关键,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
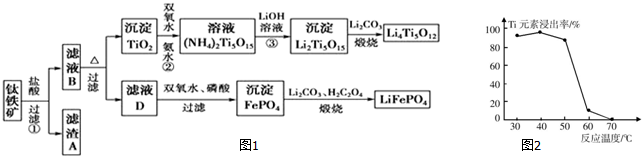
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
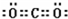 ;E的单质在空气中燃烧所生成物质的化学式SO2.
;E的单质在空气中燃烧所生成物质的化学式SO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com