
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
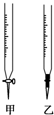 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.03 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.59 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
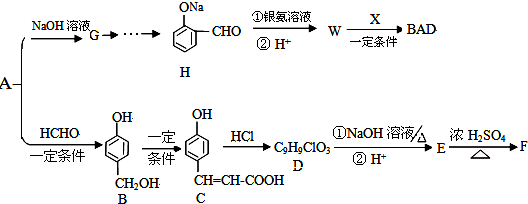
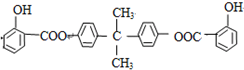
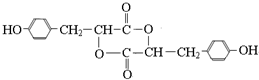
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的最高价氧化物的水化物碱性越强,该元素的金属性就越强 |
| B、元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 |
| C、元素的单质和水的反应越剧烈,该元素的非金属性就越强 |
| D、元素的单质越容易和氢气化合,该元素的金属性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、NaClO |
| C、KMnO4 |
| D、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a是阴极 |
| B、电解过程中溶液的浓度不变 |
| C、电解过程中b极质量减少 |
| D、阳极与阴极上的产物的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com