
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素。
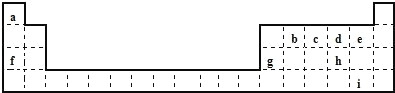
请回答下列问题:
(1)b、c、d三种元素的原子半径最大的是_________ (填元素符号);f、g对应的离子中离子半径较大的是_________(填离子符号)。
(2)i元素在周期表中的位置为_________;在元素 b、c、d、e、h、i的氢化物中,热稳定性最强的是________(填氢化物的化学式)。
(3)d、f、h三种元素形成的具有较强还原性的化合物A,与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯气体,该反应的离子方程式为_________ ;生成 标准状况下56L二氧化氯时,转移电子的数目为_________个。
(4)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的离子方程式:①________;②________。所得溶液中溶质物质的量浓度为__________(液体的体积变化忽略不计)。
【答案】 C Na+ 第四周期,第ⅦA族 HF SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O 2.5 NA 2Na+2H2O=2Na++2OH—+H2↑ 2Al+2OH—+2H2O=2AlO2—+3H2↑ 1mol/L
【解析】
根据元素周期表知,a、b、c、d、e、f、g、h、i分别是H、C、N、O、F、Na、Al、S、Br。
(1)同一周期元素,原子半径随着原子序数增大而减小,所以b、c、d三种元素的原子半径最大的是C;电子层结构相同的离子,离子半径随着原子序数增大而减小,f、g对应的离子中离子半径较大的是Na+,故答案为:C;Na+;
(2)i为Br元素,位于第四周期第VIIA族;在元素b、c、d、e、h、i中非金属性最强的是F元素,则HF的热稳定性最强,故答案为:第四周期,第ⅦA族;HF;
(3)d、f、h三种元素形成的具有较强还原性的化合物A为亚硫酸钠,亚硫酸钠与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯气体,同时生成硫酸根离子和水,离子方程式为:SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O;56L氯气的物质的量=![]() =2.5mol,由方程式可知转移电子数为2.5mol,即2.5NA个,故答案为:SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O;2.5NA;
=2.5mol,由方程式可知转移电子数为2.5mol,即2.5NA个,故答案为:SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O;2.5NA;
(4)f、g元素的单质在水中完全反应生成的溶液中只含有一种,说 明Na、Al恰好反应生成NaAlO2,发 生 的 反 应 有2Na+2H2O=2Na++2OH—+H2↑、2Al+2OH—+2H2O=2AlO2—+3H2↑,根据方程式知,Na和Al的物质的量相等,设 Na、Al的物质的量都是 ymol,23y+27y=5.0,y=![]() =0.1mol,根据Na原子守恒知n(NaAlO2)=0.1mol,则c(NaAlO2)=
=0.1mol,根据Na原子守恒知n(NaAlO2)=0.1mol,则c(NaAlO2)=![]() =1mol/L,故答案为:2Na+2H2O=2Na++2OH—+H2↑;2Al+2OH—+2H2O=2AlO2—+3H2↑;1mol/L。
=1mol/L,故答案为:2Na+2H2O=2Na++2OH—+H2↑;2Al+2OH—+2H2O=2AlO2—+3H2↑;1mol/L。


科目:高中化学 来源: 题型:
【题目】锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等。
(1)锶(Sr)位于周期表的第___周期___族,过氧化锶(SrO2)中锶元素的化合价为______。
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式______。
(3)金属锶很活泼,在空气中易被氧化,可保存在______中(填序号)。
①水 ②酒精 ③煤油
(4)锶的性质与钙类似。已知:CaCl2 易溶于水,CaF2难溶于水,请写出硝酸锶和氟化钠反应的离子方程式______。
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体,该反应的化学方程式:______。
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10—amolL—1,c(OH—)=10—bmolL—1,已知a+b=12.向该溶液中逐滴加入 pH=X 的盐酸,测得混合溶液的部分pH如表所示。
Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的 pH | |
① | |||
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
若忽略溶液混合前后的体积变化,则X为______(用数字填空)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物中,不属于烃的衍生物的有( )
A. CH3CH3 B. CH2=CHCl
C. CH3CH2OH D. CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:碘的熔点为113℃,但固态的碘可以不经过熔化直接升华。下列说法错误的是
A. 操作①和③中的有机相从分液漏斗下端放出
B. 操作②中发生反应的离子方程式为2IO3- +5SO32-+2H+=I2+5SO42-十H2O
C. 操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶
D. 操作⑤可用如图所示的水浴装置进行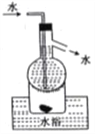
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中正确的是( )

A. 装置①可用于实验室用制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是原电池,锌电极为负极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是 ( )
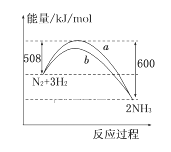
A. 加入催化剂,该化学反应的反应热改变
B. a曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为: N2+3H2![]() 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol
D. 在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(Fe2O3)颜料的工艺流程如图所示。

已知:a、b、c、x均为整数。
(1)该流程需进行多次过滤,过滤时用到的玻璃仪器为__________、__________和__________。
(2)反应Ⅰ的离子方程式为__________________,该反应的还原剂是__________(填化学式,下同),氧化产物是__________。
(3)反应Ⅱ的离子方程式为___________________________。
(4)反应Ⅵ是在45~50℃的条件下进行的,该反应中氧化剂与还原剂的物质的量之比为____________。
(5)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为_________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是

A. 贝诺酯分子中有三种含氧官能团
B. 可用 FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与 NaHCO3 溶液反应
D. 1 mol 贝诺酯最多可以与 4mol NaOH 反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com