
在100 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+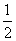 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+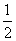 O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的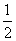 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为285.8 kJ·mol-1
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法正确的是:
A 制作航天服的聚酯纤维属于新型无机非金属材料
B 银器久置后表面会变暗,是因为发生了电化学腐蚀
CLi是最轻的金属也是活动性很强的金属,是制造电池的理想物质
D海水提取溴、煤的液化、焰色反应都发生了化学变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
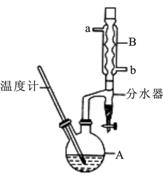 ①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应
(填“上”或“下”)口倒出。
(4)步骤③中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 (精确到1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C(石墨,s)===C(金刚石,s)(吸热反应),P4(白磷,s)===4P(红磷,s)(放热反应),下列判断正确的是( )
A.说明金刚石的内能比石墨低
B.说明红磷比白磷稳定
C.说明红磷比金刚石稳定
D.此种变化为物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是
2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)+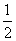 O2(g)===H2O(g),反应过程中能量变化如图,问:
O2(g)===H2O(g),反应过程中能量变化如图,问:
(1)a、b、c分别代表什么意义?
a______________;b____________;c__________。
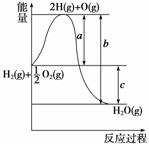
(2)该反应是放热反应还是吸热反应?__________。ΔH大于零还是小于零?________
(3)若已知2H2(g)+O2(g)===2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH2=-Q2
则ΔH1______ΔH2,Q1______Q2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化的下列描述:①放热;②吸热;③2.44 kJ;
④4.88 kJ;⑤88 kJ。其中正确的是( )
A.②和⑤ B.①和③ C.②和④ D.②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
在50 mL 0.2 mol·L-1 CuSO4溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中CuSO4溶液的浓度________(填“增大”、“减小”或“不变”)。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是________________________________________________________________________
________________________________________________________________________。
(3)若阳极为纯锌,阴极为铜片,如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是 ( )
A.H2S、H2O、HF的稳定性依次增强
B.RbOH、KOH、Mg(OH)2的碱性依次减弱
C.Na+、Mg2+、Al3+的氧化性依次减弱
D.H2SiO3、H2CO3、H2SO4酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com