
分析 电离度α(H2A)>α(HA-),氢离子或氢氧根离子抑制HA-的电离和水解,结合弱电解质的电离平衡和盐类的水解平衡移动的影响因素分析.
解答 解:C中的HCl与NaHA发生反应HCl+NaHA=H2A+NaCl后,得到0.005mol/LH2A、0.015mol/LNaHA的混合溶液,
D中0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合以后,发生反应NaOH+NaHA=Na2A+H2O,得到的是0.01mol/LNa2A溶液,以第一步水解为主,则c(A2-)最大,
根据相同浓度时的电离能力K1>>K2可知,C溶液中的HA-基本不电离,对溶液中c(H+)的增大贡献极小,
由于浓度大,对H2A的电离平衡起抑制作用,致使C中c(H+)不如溶液A大,但c(H2A)大于A,
所以,A中的溶质是0.01mol•L-1的H2A,B中的溶质是0.01mol•L-1的NaHA,C中的溶质是0.005mol/LH2A、0.015mol/LNaHA,D中的溶质是0.01mol/LNa2A,
(1)c (H+)相同浓度时的电离能力K1>>K2可知,且HA-抑制酸电离,所以c(H+)大小顺序为:A>C>B>D,故答案为:A>C>B>D;
(2)HA-抑制酸电离,所以c(H2A)最大的是C,HA-的水解程度最小,所以c(H2A)最小的是D,所以c (H2A)大小顺序为:C>A>B>D,故答案为:C>A>B>D;
(3)盐类水解程度都较小,所以c(A2-)最大的是D,H2A第二步电离程度较小,所以c(A2-)最小的是A,所以c (A2-)大小顺序为:D>B>C>A,故答案为:D>B>C>A.
点评 本题考查了离子浓度的大小,明确溶液中的溶质及其性质是解本题关键,根据弱电解质的电离特点及盐类水解特点来分析解答,题目难度不大.


科目:高中化学 来源: 题型:推断题
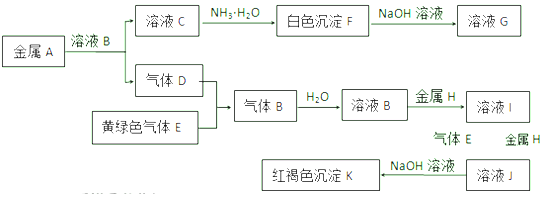
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
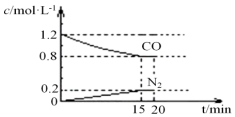 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
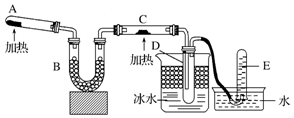
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的分子数 | |
| B. | 1molH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下22.4LCO气体中含有的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN浓液 | 有气体生成,溶液未呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4- |
| D | 将0.1mol/LMgSO4溶液滴入NaOH溶液里至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp小于Mg(OH)2的Ksp |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-═Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-3e-═Fe3+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解500mL硝酸银溶液,当消耗铜电极32 g时,电解池溶液中pH=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com