
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
化合物 | 燃烧热 | 化合物 | 燃烧热 |
甲烷 | 891.0 | 正丁烷 | 2 878.0 |
乙烷 | 1560.8 | 异丁烷 | 2 869.6 |
丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
(1)已知:物质的能量越高越不稳定,根据表中的数据,比较正丁烷、异丁烷的热稳定性:正丁烷______异丁烷(填“>”、“=”或“<”)。
(2)写出乙烷燃烧的热化学方程式:________________________
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量______(填“越多”、“越少”或“相同”)。
(1)< (2)2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3121.6kJ/mol (3)越少
【解析】
试题分析:根据表中的数据可以看出:正丁烷的燃烧热为2 878.0 kJ/mol;而异丁烷的燃烧热为2 869.6 kJ/mol。由于物质的能量越高越不稳定,因此稳定性正丁烷<异丁烷。(2)根据已知的燃烧热的数据可得乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3121.6kJ/mol。(3) 对于烷烃来说,分子式通式为CnH2n+2。可见:随着分子中C原子数的增多,C的含量逐渐增大。1g甲烷完全燃烧产生的热量为891.0KJ÷16=55.7KJ;1g乙烷完全燃烧产生的热量为1560.8KJ÷30=52.0KJ;对其它烷烃进行计算会发现:相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少。
考点:考查物质的稳定性与能量的关系、烷烃的燃烧热化学方程式的书写及燃烧放出热量的变化规律。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意如下图,下列说法正确的是

A.a极为电池的正极
B.电池工作时电子由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e=2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:实验题
(8分)实验室用乙酸和正丁醇制备乙酸正丁酯的原理如下:
CH3COOH+CH3CH2CH2CH2OH  CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
有关物质的物理性质如下表,请回答有关问题。
化合物 | 密度/g·cm-3 | 沸点/℃ | 溶解度/g |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | ∞ |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及冷凝回流管,加热冷凝回流反应。
(1)沸石的作用
________________________________________________________________________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是
__________________ ____________;
________________________________________________________________________。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤。正确的操作步骤是________(填字母)。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:选择题
已知如下两个热化学反应方程式。
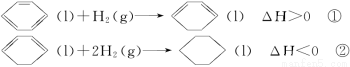
下列说法不正确的是
A.反应①、②都属于加成反应
B.在通常条件下,反应①、②都能自发进行
C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键
D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:填空题
已知A(g)+B(g) 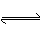 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时 c(A)= mol·L-1, C的物质的量= mol;
若经一段时间后,反应达到平衡,则此时A的转化率= ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 ( 填“变大”或“变小”或“不变”);
(3)判断该反应达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)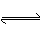 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.lmol/L盐酸后,pH最大的是①
D.若用Pt电极电解3种溶液一段时间后,pH均不变
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
②Fe2O3(s)+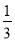 CO(g)=
CO(g)= 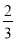 Fe3O4(s)+
Fe3O4(s)+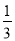 CO2(g) ΔH=-15.73kJ·mol-1
CO2(g) ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ·mol-1
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218kJ·mol-1 B.-109kJ·mol-1
C.+218kJ·mol-1 D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(16分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3- 、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是
和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。
A.Br- B.SO C.CH3COO- D.HCO
C.CH3COO- D.HCO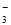
②A中阴、阳离子个数比为
③B的水溶液中所有离子的浓度由大到小的顺序为
(用离子符号表示)。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1 g)。
(3)将Cu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的 (填离子符号),有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列化学用语使用正确的是
① CH4 分子的球棍模型: ②次氯酸的电子式
②次氯酸的电子式 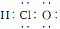
③ CO2分子的结构式:O==C==O ④聚氯乙烯的单体结构简式为CH2==CHCl
⑤葡萄糖的最简式(实验式):CH2O
A.①④⑤ B.②③④ C.②④⑤ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com