
【题目】下列物质不能由化合反应直接一步得到的是
A. FeCl3 B. H2SiO3 C. FeCl2 D. Fe(OH)3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实与胶体的性质无关的是
A. 土壤中离子的吸附和交换过程,有保肥作用
B. 由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
D. 臭氧可用于水的消毒净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北魏贾思勰《齐民要术·作酢(zuò,今醋也)法》这样描述乌梅苦酒法:“乌梅去核,一升许肉,以五升苦酒渍数日,曝干,擣作(dǎo,同“捣”)作屑。欲食,辄投水中,即成醋尔。”下列有关醋的说法中正确的是
A. 醋的主要成分是非电解质 B. 醋的主要成分是强电解质
C. 醋的主要成分是弱电解质 D. 醋中只存在分子,不存在离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:

写出酸浸的主要化学方程式:______________________。
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
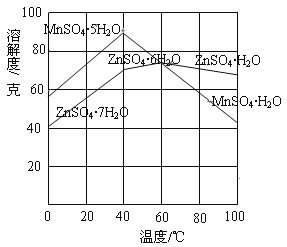
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
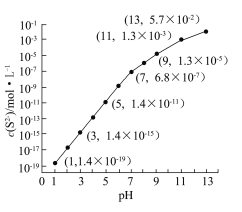
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酰胺(H2C=CH—CONH2)具有致癌性和遗传毒性。丙烯酰胺主要是由高碳水化合物、低蛋白质的植物性食物在加热(120 ℃以上)过程中形成,特别在烘烤、油炸时更易形成。丙烯酰胺可以进一步形成在工业上有用的聚丙烯酰胺类物质。

回答下列问题:
(1)D的结构简式为______________;F的结构简式为______________。
(2)指明下列反应类型:A→B____________________,C→D______________________。
(3)丙烯酰胺有多种同分异构体,写出分子中同时含有醛基和碳碳双键的同分异构体:______________________。
(4)写出化学方程式D→E:__________________________________________。2分子C在浓硫酸作用下可形成一个六元酯环,该反应的化学方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com