
| 实验步骤 | 预期现象和结论 |
| 步骤1:取1mLA溶液于一试管中,加入约2mL的CCl4,充分振荡后静置. | |
| 步骤2: |
| 实验步骤 | 预期现象和结论 |
| 溶液分层,下层液体呈红棕色 说明原A溶液中有Br2 | |
| 步骤2:用滴管取出上层溶液于另一试管中,滴加几滴0.1molL-1KSCN | 溶液变血红色 说明原溶液A中有Fe3+ 结合两现象,证明假设3成立 |


科目:高中化学 来源: 题型:
| A、③⑥ | B、①③⑥ |
| C、①③④⑥ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-
| ||||
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | ||||
| C、酸性高锰酸钾溶液与双氧水反应:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O | ||||
| D、碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
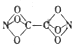 某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、C、N、0的第一电离能依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1: | 火焰呈黄色,证明原溶液中存在Na+. |
| 步骤2: | |
| 步骤3:另取少量原溶液于试管中, | 品红溶液褪色,证明原溶液中存在SO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com