
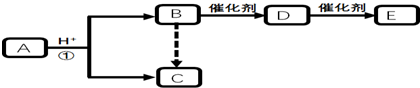
分析 A在酸性条件下水解得到B、C,说明A中含有酯基,B、C、D分子含碳原子个数相同,B转化得到C,则B为醇,C为羧酸,C的相对分子质量为60,且分子中碳元素的质量分数为40%,分子中C原子数目为$\frac{60×40%}{12}$=2,只能含有一个羧基,可推知C为CH3COOH,则B为CH3CH2OH,A为CH3COOCH2CH3,E为高分子化合物,则乙醇发生消去反应生成D为CH2=CH2,乙烯发生加聚反应得到E为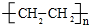 .
.
解答 解:A在酸性条件下水解得到B、C,说明A中含有酯基,B、C、D分子含碳原子个数相同,B转化得到C,则B为醇,C为羧酸,C的相对分子质量为60,且分子中碳元素的质量分数为40%,分子中C原子数目为$\frac{60×40%}{12}$=2,只能含有一个羧基,可推知C为CH3COOH,则B为CH3CH2OH,A为CH3COOCH2CH3,E为高分子化合物,则乙醇发生消去反应生成D为CH2=CH2,乙烯发生加聚反应得到E为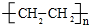 .
.
(1)B为CH3CH2OH,B中含有的官能团名称为羟基,
故答案为:羟基;
(2)E为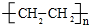 ,链节为-CH2-CH2-,
,链节为-CH2-CH2-,
故答案为:-CH2-CH2-;
(3)反应①的化学方程式:CH3COOCH2CH3+H2O$→_{△}^{H+}$CH3COOH+CH3CH2OH,
故答案为:CH3COOCH2CH3+H2O$→_{△}^{H+}$CH3COOH+CH3CH2OH.
点评 本题考查有机物推断,涉及糖、酯、醇、醛、羧酸、烯烃的性质与转化,关键是确定C为乙酸,注意对基础知识的理解掌握.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-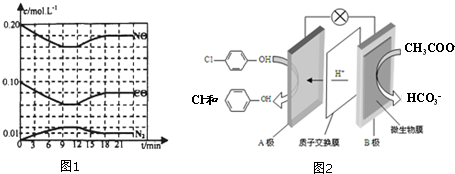
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝与Fe2O3发生铝热反应后固体物质质量不变 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl2═AlCl3+3H2↑可知:2Fe+6HCl2═FeCl3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
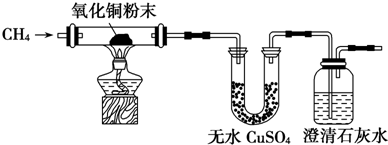
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
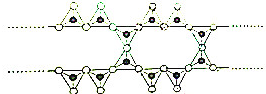 在结构中,
在结构中,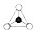 表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.
表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com