
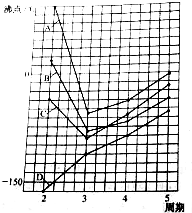
 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物. 分析 同一主族元素氢化物中,氢化物的沸点随着原子序数增大而呈增大趋势,但含有氢键的氢化物熔沸点最高;同一周期元素氢化物中,含有氢键的氢化物沸点较高,第二周期元素氢化物中水的沸点最高.
解答 解:同一主族元素氢化物中,氢化物的沸点随着原子序数增大而呈增大趋势,但含有氢键的氢化物熔沸点最高;同一周期元素氢化物中,含有氢键的氢化物沸点较高,第二周期元素氢化物中水的沸点最高,所以表示ⅥA族元素气态氢化物沸点的是A曲线;
ⅣA族元素气态氢化物中都不含氢键,其沸点随着相对分子质量增大而增大,所以沸点的是曲线D;
同一族中第3、4、5周期元素气态氢化物都不含氢键,氢化物的沸点与其分子间作用力有关,分子间作用力与相对分子质量成正比,所以同一族中第3、4、5周期元素气态氢化物的沸点随着相对分子质量增大而增大,则同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,
故答案为:A;D;同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
点评 本题考查氢键对氢化物熔沸点的影响、同一主族及同一周期氢化物熔沸点变化规律,为高考高频点,明确存在氢键的物质、氢键只影响物理性质不影响化学性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 实验编号 | 起始浓度/mol•L | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
| A. | X>0.05 | |
| B. | 将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大 | |
| C. | 实验①所得溶液c(A-)+c(HA)=0.10mol•L-1 | |
| D. | 实验②所得溶液:c(Na+)+c(OH-)=c(A-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是吸热反应,且A不是气态 | B. | 正反应是放热反应,且A不是气态 | ||
| C. | 正反应是吸热反应,且A是气态 | D. | 正反应是放反应,且A是气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com