
【题目】可逆反应mA(s) +nB(g) ![]() pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图。根据图中曲线分析,判断下列叙述中正确的是
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图。根据图中曲线分析,判断下列叙述中正确的是
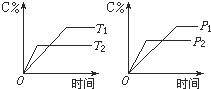
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后,增大A的量,有利于平衡向正反应方向移动
D.方程式中一定m+n<p+q
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法正确的是
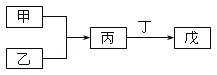
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是 ;
31Ga的第一电离能却明显低于30Zn,原因是 ;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3 分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是: (用相关的离子方程式和简单的文字说明加以解释)
(3)图甲所示的二维平面晶体示意图中表示化学式为AX3的是________。
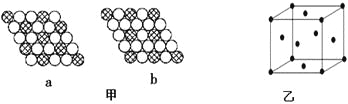
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol X能与足量碳酸氢钠溶液反应放出44.8 L CO2(标准状况),则X的分子式是
A. C5H10O4 B. C4H8O4 C. C3H6O4 D. C2H2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: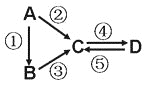
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出②反应的离子方程式_____________;④反应的离子方程式______________;
(2)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水反应的化学方程式__________________。④反应的离子方程式___________________;
D中加入氢氧化钠的现象是_____________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,且溶液均显碱性,④反应也是通入一种引起温室效应的主要气体。写出②反应的化学方程式______________________________________。
⑤反应用到B,反应条件为高温,则⑤的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为
A. 0.02g B. 0.46g C. 0.80g D. 0.23g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com