
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
(1)极性(2分)
(2)60%(2分) CF(2分,全对得2分,只选1个且正确的得1分,选错1个扣1分)
(3)(b-a-4c)/2(3分)
(4)CH3OH-6e-+8OH-=CO32-+6H2O(3分) 3.2g(3分,数值正确、未写单位的扣1分)
【解析】
试题分析:(1)甲醇分子中的化学键都是极性键,且甲醇分子结构不对称,故甲醇是极性分子;(2)①根据化学平衡三行式计算,设消耗的一氧化碳物质的量为x;
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=3×3/5x=0.6
一氧化碳转化率=60%;②A、2v(H2)=v(CH3OH),没有明确是正、逆反应速率 ,且速率之比不等于化学计量数之比,不能作为平衡标志,错误;B、CO的消耗速率等于CH3OH的生成速率,均为正反应速率,不能作为平衡标志,错误;C、随着反应的进行,容器内气体的物质的量不断改变,容器内的压强不断改变,若容器内的压强保持不变,说明反应达到平衡状态,正确;D、根据质量守恒定律知,容器内气体质量不变,体积固定,混合气体的密度保持不变,不能说明反应达到平衡状态,错误;E、反应混合气中各组分均为无色气体,混合气体的颜色保持不变,不能说明反应达到平衡状态,错误;F、根据质量守恒定律知,随着反应的进行,容器内气体质量不变,物质的量变化,混合气体的平均相对分子质量不断变化,若混合气体的平均相对分子质量不随时间而变化,说明反应达到平衡状态,正确;选CF;(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-akJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-bkJ?mol-1
③H2O(g)═H2O(l)△H═-ckJ?mol-1
依据盖斯定律计算,①/2—②/2+③×2得到热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H═(b-a-4c)/2 kJ·mol﹣1;(4)①由甲醇、氧气和NaOH溶液构成的燃料电池,通入甲醇的一极发生氧化反应生成碳酸根和水,作原电池的负极,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;②根据题意知,阳极电极反应为:2Cl --2e-=Cl2↑,4OH--4e-=2H2O+O2↑, 阴极电极反应为:Cu2++2e-=Cu, 2H++2e-=H2↑;阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x,根据电子守恒将题给数据代入列式:0.4+4x=0.2+0.4+2x,解得x=0.1mol,阳极上收集到氧气的物质的量0.1mol,质量为3.2g。
考点:考查分子极性的判断,平衡转化率计算和平衡状态的判断,热化学方程式书写和盖斯定律,原电池和电解原理的应用。


科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
下列关于反应热的叙述,正确的是( )
A.吸热反应一定要高温才能发生
B.1mol酸与碱恰好中和时所放出的热量叫中和热
C.已知C(s,石墨)=C(s,金刚石) △H=+1.9 kJ/mol,则石墨比金刚石稳定
D.已知2H2(g)+O2(g)=2H2O(g) △H= —483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
一种碳纳米管(氢气)二次电池原理如右下图。该电池的电解质为6mol/L KOH溶液,下列说法正确的是
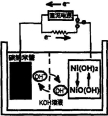
A.储存H2的碳纳米管放电时为负极,充电时为阳极
B.充电时阳极反应为NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣
C.放电时正极附近溶液的pH减小
D.放电时负极反应为H2+2OH﹣﹣2e﹣=2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是
A.在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
B.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏
C.白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g酒精
D.回收废弃塑料制成燃油或回收地沟油制生物柴油,可减轻环境污染和节约化石能
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.高熔点的固体如果不是离子晶体,则一定为原子晶体
B.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S
C.由两种元素组成的共价化合物分子中,只可能存在极性键
D.若X+ 和Y2-的核外电子层结构相同,则原子序数:X>Y
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如题6图.下列说法正确的是

A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:简答题
(13分)
有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4,且A不能使Br2的CCl4溶液褪色;1mol B反应生成了2mol C.
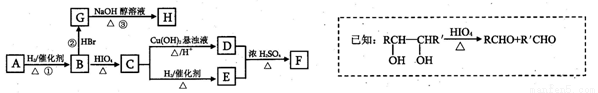
请回答下列问题:
(1)C—E的反应类型为 。
(2)若①,②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H'的总产率为 。
(3)A的结构简式为 。
(4)写出C与银氨溶液反应的离子方程式为____。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为 。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列性质比较中不正确的是
A.沸点的高低: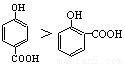 B.熔点:SiO2>CsCl>CBr4>CF4
B.熔点:SiO2>CsCl>CBr4>CF4
C.硬度:镁>铝>镁铝合金 D. 水溶性:HF>Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
用下图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是
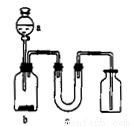
气体 | a | b | C | |
A |
| 浓氨水 | 生石灰 | 碱石灰 |
B |
| 稀硝酸 | 铜片 | 碱石灰 |
C |
| 浓硫酸 | 浓盐酸 | 氯化钙 |
D | SO2 | 浓硫酸 | 铜片 | 硅胶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com