
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH﹣△H>0,下列叙述正确的是( )
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
C.向水中加入金属钠,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH不变
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为验证SO2的性质设计如图所示的实验装置,下列说法错误的是( )
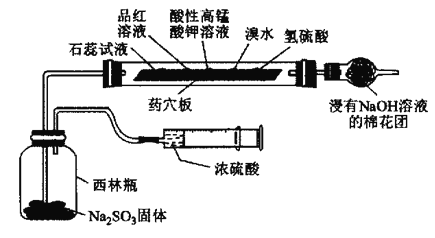
A.一段时间后石蕊溶液和品红溶液均褪色,说明SO2有漂白性
B.一段时间后酸性高锰酸钾溶液、溴水褪色,说明SO2有还原性
C.一段时间后氢硫酸溶液中有淡黄色沉淀生成,说明SO2有氧化性
D.该装置能体现实验的微型化和绿色化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
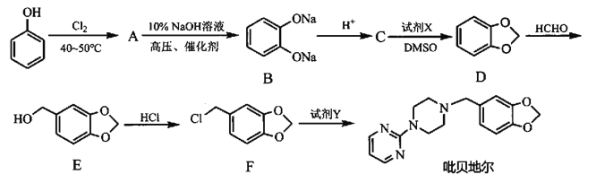
【题目】吡贝地尔可用于治疗帕金森病,对于控制帕金森病的震颤、运动迟缓、肌张力增高有一定的作用。另外对于不宁腿综合征也有治疗效果。其合成路线如下:
已知:①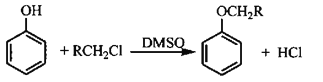
②![]()
回答下列问题:
(1)物质A的结构简式为______,检验A中非含氧官能团所用试剂的先后顺序为____________(填化学式),物质F中含氧官能团的名称为______。
(2)写出C转化为D的化学反应方程式:__________________,D生成E的反应类型为______,试剂Y的结构简式为______。
(3)G与E互为同分异构体,请写出符合下列条件的G的结构简式:______(写出1个即可)。
①遇FeCl3溶液显色 ②能发生银镜反应 ③含有一个手性碳原子
(4)请结合题目中的相关信息,以物质C、1,1-二氯乙烷、乙醛为原料,设计合成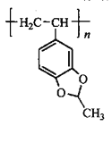 的路线(其他试剂任选)。__________
的路线(其他试剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是

A. 放电过程中,Li+向负极移动
B. 正极反应式:Ca+2Cl-—2e-=CaCl2
C. 每转移0.1mol电子,理论上生成10.35gPb
D. 常温时,在正负极间接上电流表或检流计,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是

A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
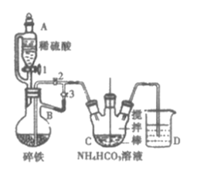
(1)仪器B的名称是___。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___,然后打开活塞2,关闭活塞___。
Ⅱ.制备乳酸亚铁:向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为___。为防止乳酸亚铁变质,在上述体系中还应加入___,反应结束后,从所得溶液中获得乳酸亚铁晶体的步骤如下,请将前四步正确排序(写字母序号):___,干燥。
a.过滤 b.隔绝空气,加热 c.冷却结晶 d.用适量乙醇洗涤
Ⅲ.乳酸亚铁晶体纯度的测量;
(4)用K2Cr2O7滴定法测定样晶中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0100mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应速率的说法中,正确的是
A.决定化学反应速率的因素是反应物本身的性质
B.对反应C(s)+CO2(g)![]() 2CO(g),其他条件不变时,增加C的量能使反应速率增大
2CO(g),其他条件不变时,增加C的量能使反应速率增大
C.其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.如图实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
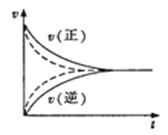
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com