


分析 由流程可知,铝土矿加入盐酸溶解过滤得到二氧化硅固体和滤液A,滤液A中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,反应的化学方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+,目的是氧化亚铁离子,所得滤液B显酸性,B中铝离子、铁离子可水解显酸性;二氧化硅加入氢氧化钠固体焙烧得到硅酸钠,
(1)①利用KSCN溶液检验铁离子;
②滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱酸弱碱选择;
③加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤洗涤;
(2)a、蒸发皿中含有二氧化硅和氢氧化钠反应;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;
c、玻璃中含二氧化硅和氢氧化钠反应;
d、瓷坩埚含有二氧化硅和氢氧化钠反应.
解答 解:由流程可知,铝土矿加入盐酸溶解过滤得到二氧化硅固体和滤液A,滤液A中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,反应的化学方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+,目的是氧化亚铁离子,所得滤液B显酸性,B中铝离子、铁离子可水解显酸性;二氧化硅加入氢氧化钠固体焙烧得到硅酸钠,
(1)①检验滤液B中是否还含有铁元素的操作方法为取少量滤液B,加入KSCN溶液,若不变红,再加少量氯气,仍然不变红,则说明B中不含铁元素,
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加少量氯气,仍然不变红,则说明B中不含铁元素;②滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出;
a、氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,故a不是最好;
b.硫酸溶液不能沉淀铝离子,故b不符合;
c.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故c符合;
d.二氧化碳和氯化铝不反应不能生成氢氧化铝沉淀,故d不符合;
故答案为:c;
③加入浓盐酸抑制氯化铝的水解,蒸发浓缩、冷却结晶,过滤,洗涤,故答案为:冷却结晶;
(2)A、蒸发皿中含有二氧化硅和氢氧化钠反应,故A不符合;
B、铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;
C、玻璃中含二氧化硅和氢氧化钠反应,故C不符合;
D、瓷坩埚含有二氧化硅和氢氧化钠反应,故D不符合;
故答案为:B.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
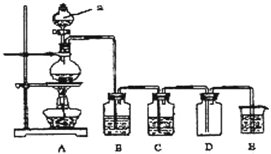 如图是实验室中制备气体或验证气体性质的装置图
如图是实验室中制备气体或验证气体性质的装置图查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
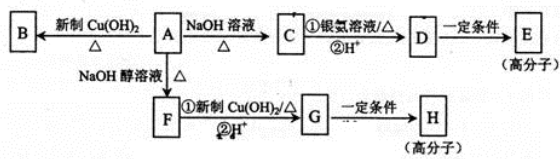
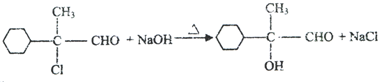 .
.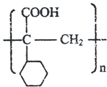 ,E的结构简式是
,E的结构简式是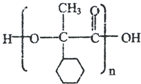 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com