
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
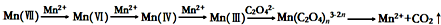
分析 (1)根据表中数据知,有硫酸锰的溶液褪色时间短,反应速率快,没有硫酸锰的溶液褪色时间长、反应速率慢;
(2)根据对比实验中不同物理量确定褪色时间长短,从而确定反应速率的影响因素;
(3)酸性条件下,高锰酸钾具有强氧化性,能氧化还原性物质,所以草酸和高锰酸钾发生氧化还原反应生成硫酸锰、二氧化碳和水,导致溶液褪色;
滴定完成后仰视读取KMnO4溶液体积会导致高锰酸钾溶液体积偏大;
(4)根据流程图知,酸性高锰酸钾被还原生成二价锰离子,导致溶液褪色,且反应开始时高锰酸根离子被锰离子还原.
解答 解:(1)根据表中数据知,有硫酸锰的溶液褪色时间短,反应速率快,没有硫酸锰的溶液褪色时间长、反应速率慢,说明硫酸锰作催化剂而加快反应速率,故答案为:Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂];
(2)①根据实验II、III知,温度不同其褪色时间不同,说明温度对该反应速率有影响,故①正确;
②根据实验III知,混合溶液中硫酸浓度不同其褪色时间不同,说明硫酸对草酸和KMnO4溶液的反应有影响,故②正确;
③根据实验III知,加入少量硫酸,可促进草酸和KMnO4溶液反应,褪色时间变短,而加入大量硫酸,反应速率比较小,褪色时间加长,故③正确;
④根据实验三知,在酸性范围内,pH值越小褪色时间越长,则对反应越不利,故④错误;
故答案为:①②③;
(3)酸性条件下,高锰酸钾具有强氧化性,能氧化还原性物质,所以草酸和高锰酸钾发生氧化还原反应生成硫酸锰、二氧化碳和水,离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,导致溶液褪色,所以当溶液由无色变为紫红色且半分钟内不变色时,说明达到滴定终点;滴定完成后仰视读取KMnO4溶液体积会导致高锰酸钾溶液体积偏大,则导致测定溶液浓度偏大;
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;从无色变为浅紫红色;偏大;
(4)根据流程图知,酸性高锰酸钾被还原生成二价锰离子,导致溶液褪色,且开始时既有锰离子参加反应,只有实验I中加入硫酸锰,所以实验I可证明这个历程是可信的,
故答案为:I.
点评 本题考查探究反应速率的影响因素,侧重考查学生实验操作、观察、分析能力,知道物质的性质是设计实验的依据,利用对比方法进行实验并得出正确结论,题目难度中等.


科目:高中化学 来源: 题型:解答题
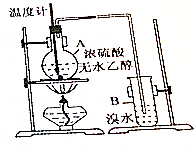 已知乙醇与浓硫酸加热到170℃时可生成乙烯:
已知乙醇与浓硫酸加热到170℃时可生成乙烯:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 坩埚的质量 | 坩埚的质量+晶体质量 | 失水后坩埚的质量+固体质量 |
| 11.70g | 14.2g | 13.2g |
| A. | 晶体中含有不分解的杂质 | B. | 没有放在干燥器中冷却 | ||
| C. | 实验前,晶体表面吸附水 | D. | 没有进行恒重操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
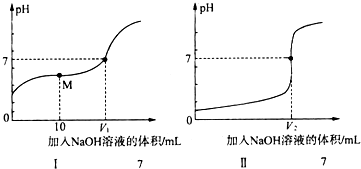
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 当V=20 mL时,溶液中:c(OH-)=c(HF)+c(H+) | |
| C. | 当V=20 mL时,溶液中:c(F-)=c(Na+)=0.1mol/L | |
| D. | 当v>0时,溶液中一定存在c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
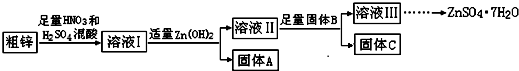
 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com