
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
分析 (1)由表中数据可知,c(N2O5)浓度之比等于v正之比,则m=1,由任意一组数据根据v正=k正.c(N2O5)计算k正;
(2)根据v正=k正.c(N2O5)计算;
(3)对3min时对比,第4min时,浓度减小,但题目缺少4min之后的数据,不能确定是否达到平衡状态,以此解答.
解答 解:(1)温度不变,则k正相等,对比1、2min数据可知$\frac{0.08{0}^{m}}{0.13{3}^{m}}$=$\frac{0.028}{0.0466}$,m≈1,由2min数据可知,0.028mol.L-1.min-1=k正×0.080mol.L-1,解得k正≈0.35min-1,
故答案为:1;0.35min-1;
(2)340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.100mol•L-1×0.35min-1=0.035mol.L-1.min-1,故答案为:0.035mol.L-1.min-1;
(3)对3min时对比,第4min时,浓度减小,但题目缺少4min之后的数据,不能确定是否达到平衡状态,则此时v正≥v逆,
故答案为:≥.
点评 本题考查化学平衡的计算,为高频考点,侧重雨学生的分析能力和计算能力的考查,注意对数据的分析归纳,题目有利于培养学生良好的科学素养,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
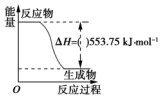 (1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
(1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 1×10-17 | 8×10-16 | 4×10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中 | |
| C. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| D. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 一束光线分别通过溶液和胶体时,前者会出现明显的光带,后者则没有 | |
| D. | 浓NaOH溶液中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
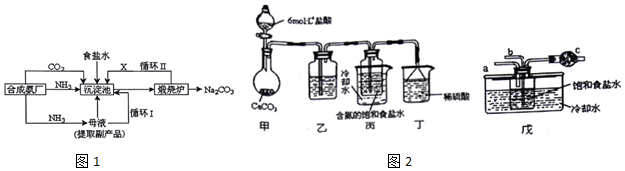
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com