

分析 (1)根据钠的正电性较强对核外电子的吸引力比氖更强,要想失去电子需要更多的能量,据此进行分析;
(2)Al原子未成对电子数为1,气态氯化铝的分子组成为(AlCl3)2,存在共价键和配位键,这里Al原子与四个配位的Cl原子连接,是sp3杂化;
(3)水分子成笼的作用力是 分子间作用力,具体表现为氢键,A中最小的环中连接的原子总数是10;中间笼实际占有15个水分子;
(4)空间利用率为晶胞内硬球的总体积占晶胞体积的百分比,根据晶胞A点原子的坐标,C点原子坐标和D点原子坐标解答.
解答 解:(1)根据钠的正电性较强对核外电子的吸引力比氖更强,要想失去电子需要更多的能量,因此钠的第二电离能比氖的更高.故答案为:>;
(2)Al原子未成对电子数为1,第四周期各金属元素中,未成对电子数也为1的有K,Sc,Cu,Ga,共有4种;气态氯化铝组成为二聚体(AlCl3)2,这里Al与4个配位的Cl成键,3个为共价键,一个为配位键,则分子中含有的化学键类型为共价键、配位键,Al的杂化方式为sp3杂化.
故答案为:4,共价键、配位键,sp3杂化;
(3)可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子),水分子成笼的作用力是 分子间作用力,具体表现为氢键;图A中最小的环连接有5个水分子,一个水分子有2个原子,因此最小的环连接的原子数为5×2=10;可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼有10个水分子且不均摊,两个面与另外的笼是共面关系,面为正五边形,5个水分子,则实际占有$10+5×2×\frac{1}{2}=15$个水分子.故答案为:氢键,10,15;
(4)六方最密堆积(hcp)不再是立方结构,晶胞参数已经不同于立方晶系,六方最密堆积晶胞实为等径硬球接触,上一层嵌于下一层的凹处,上下关系抽象在晶胞内其实是正四面体关系,因此晶胞C中虚线所标的四个硬球关系为正四面体关系,设晶胞底边长为xcm,即$\overline{AC}=xcm$,利用立体几何知识,不难求出晶胞底边长与正四面体的高度之间的关系为$h=\frac{\sqrt{6}}{3}xcm$,这里不妨把B层看成晶胞中层,则晶胞上下两层关系与正四面体高h的关系,也不难由立体几何知识求出,为$b=2h=\frac{2\sqrt{6}}{3}xcm$,由于金属Mg的原子半径为acm,根据硬球接触模型,$b=\frac{4\sqrt{6}}{3}acm$,对于六方晶胞,一个晶胞的顶点原子占晶胞的$\frac{1}{8}$,晶胞内部原子为整个晶胞所有,则一个六方晶胞内的原子数为$8×\frac{1}{8}+1=2$,则一个晶胞的体积为$V={x}^{2}bsin60°=2\sqrt{3}{a}^{2}b$,一个晶胞内硬球的总体积为${V}_{0}=2×\frac{4}{3}π{a}^{3}=\frac{8π{a}^{3}}{3}$,则空间利用率为$\frac{{V}_{0}}{V}×100%$=$\frac{4πa}{3\sqrt{3}b}×100%$,其实算到这里就可以了,如接着算下去,可以发现空间利用率为$\frac{4πa}{3\sqrt{3}b}×100%=\frac{\sqrt{2}}{6}π×100%=74.05%$,这就是六方最密堆积(hcp)的空间利用率!
晶胞中A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),B处于正四面体顶角原子处,根据立体几何知识,不难求出B原子的原子坐标为($a,\frac{\sqrt{3}a}{3},\frac{b}{2}$).
故答案为:$\frac{4πa}{3\sqrt{3}b}×100%$,$(a,\frac{\sqrt{3}a}{3},\frac{b}{2})$.
点评 本题考查物质结构知识,包含电离能的比较,元素周期表,杂化轨道理论,价键类型判断,以及晶胞计算.本题(3),(4)问难度较大,需要有扎实的晶体化学知识,灵活运用均摊法,同时也要有足够的空间想象能力和立体几何知识,而空间利用率和原子坐标都是大学无机化学的知识,难度还是有的.另外,对于六方晶胞,需要注意区别于立方晶胞,思维需改变过来,否则就会发生严重的错误.本题考查知识点较为综合,是中档题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化过程,都是物理变化 | |
| B. | 通过石油的裂解可得到汽油等多种产品 | |
| C. | 可用焦炭还原氧化铝的方法来冶炼铝 | |
| D. | 从海水中可以提取铀和重水等核原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙电极附近溶液的pH减小 | |
| B. | 电极丁的反应式为:MnO42--e-═MnO4- | |
| C. | KOH溶液的质量分数:c%>a%>b% | |
| D. | 导线中有2 mol电子通过时,理论上有2 mol K+移入阴极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: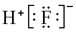 | B. | 白磷分子的球棍模型: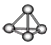 | ||
| C. | CO2分子的球棍模型: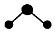 | D. | K+离子的结构示意图: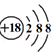 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:PO>Te | B. | 为非金属元素 | ||
| C. | ${\;}_{84}^{209}$PO的中子数为125 | D. | 在周期表中第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 放电时Ni2O3在正极被氧化 | |
| D. | 电池放电时,OH-往负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在第VIB和第ⅦB族附近可以找到耐高温金属材料 | |
| B. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| C. | 如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置 | |
| D. | 目前已知发现的第IVA族元素为5种,所以该族元素共5种单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com