
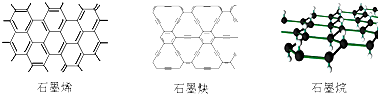
| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
分析 A.同素异形体是同种元素组成的结构不同的单质,石墨烷属于化合物;
B.每个C原子增加1个H原子后得到石墨烷,氢气物质的量为碳的一半,但氢气状态不确定,不能氢气体积;
C.石墨炔是具有优良的半导体性能,二氧化硅不是半导体材料;
D.碳原子半径大于氢原子,则石墨炔孔径大于H2分子的直径,可以容纳H2分子.
解答 解:A.同素异形体是同种元素组成的结构不同的单质,石墨烷属于化合物,故A错误;
B.每个C原子增加1个H原子后得到石墨烷,则碳原子与H原子数目相等,氢气物质的量为碳的一半,但氢气状态不确定,不能氢气体积,故B错误;
C.石墨炔是具有优良的半导体性能,可作半导体材料,但二氧化硅不是半导体材料,故C错误;
D.碳原子半径大于氢原子,则石墨炔孔径大于H2分子的直径,可以容纳H2分子,则石墨炔是理想的H2提纯薄膜,故D正确,
故选:D.
点评 本题以石墨炔为知识背景,考查了同素异形体、半导体材料等,侧重于考查学生阅读信息和应用信息的能力,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 g石墨中的C-C键数目 | |
| B. | 常温常压下,17 g ND3中所含分子数目 | |
| C. | 向含0.2 mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1 mol羟基(-OH)中所含电子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
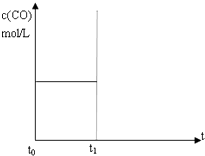 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
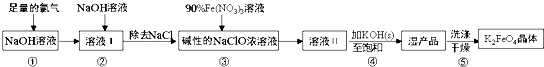
| A. | 步骤③中氧化剂与还原剂的物质的量之比为3:2 | |
| B. | 步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小 | |
| C. | 步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制 | |
| D. | 配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
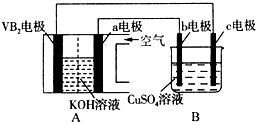 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com