
| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,对人体无任何危害 | |
| D. | 常用Na2SO3在H2SO4存在条件下,还原NaClO3来制ClO2,化学方程式为:Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
分析 A.ClO2常温下呈气态,其分子构型与水分子的分子构型相似,均为极性分子;
B.作为消毒剂,具有强氧化性,最终可生成Cl-,结合化合价变化计算;
C.氯气在饮用水中有机物发生氯代,生成对人体有害的含氯有机物;
D.Na2SO3和NaClO3在酸性条件下发生氧化还原反应生成ClO2.
解答 解:A.水分子中价层电子对为$\frac{6+2}{2}$=4,孤电子对数为$\frac{6-2×1}{2}$=2,为V形,分子构型与水分子的分子构型相似,ClO2的分子结构呈V型,正负电荷的重心不重合,电荷分布不均匀,属极性分子,故A错误;
B.作为消毒剂,具有强氧化性,最终可生成Cl-,1molClO2可得5mol电子,而1mol氯气得到2mol电子,其消毒效率(以单位体积得电子的数目)是氯气的2.5倍,故B错误;
C.氯气在饮用水中有机物发生氯代,生成对人体有害的含氯有机物,不能广泛应用,应寻找替代品,故C错误;
D.Na2SO3和NaClO3在酸性条件下发生氧化还原反应生成ClO2,方程式为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O,故D正确.
故选D.
点评 本题考查ClO2,为高频考点,侧重氧化还原反应基本概念及转移电子的考查,注意分析习题中的信息及知识迁移应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
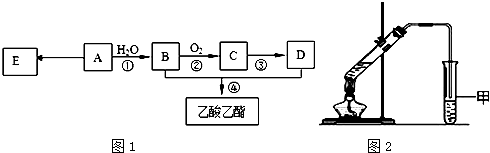
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积为22.4 L,其质量为28 g | |
| C. | 50 mL 8 mol•L-1的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA | |
| D. | 标准状况下,80 g SO3中含3NA个氧原子,体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中Fe3+的水解:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 邻羟基苯甲酸中加入足量NaHCO3溶液: +2HCO${\;}_{3}^{-}$→ +2HCO${\;}_{3}^{-}$→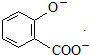 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向含NaOH的Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
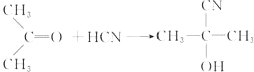
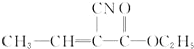 ,写出各步反应的化学方程式
,写出各步反应的化学方程式 .
.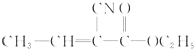 被涂在手术伤口表面,在数秒内发生固化(加聚)并起黏结作用以代替缝合,是一种性能优良的功能高分子材料,写出该化合物固化时的化学反应方程式
被涂在手术伤口表面,在数秒内发生固化(加聚)并起黏结作用以代替缝合,是一种性能优良的功能高分子材料,写出该化合物固化时的化学反应方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜棒为负极 | B. | 锌棒发生氧化反应 | ||
| C. | 锌棒质量减轻 | D. | 电子从锌棒经外电路流向铜棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
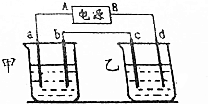 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com