
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 | |
| C. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
分析 A、NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4;
B、标准状况下,气体的摩尔体积是相同的;
C、0.1mol铁在0.1mol氯气中燃烧,铁过量,故根据氯气的物质的量来分析转移的电子数;
D、碳酸钠溶液中碳酸根离子水解生成氢氧根离子,溶液中离子总数增大.
解答 解:A、NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故A错误;
B、标准状况下,气体的摩尔体积是相同的,气体的物质的量为0.05mol,双原子分子,则原子的物质的量为0.1mol,原子数目为0.1 NA,故B正确;
C、0.1mol铁在0.1mol氯气中燃烧,铁过量,故根据氯气的物质的量来分析转移的电子数.Cl2反应后氯元素的价态变为-1价,故0.1mol氯气反应后转移0.2mol电子,个数为0.2NA个,故C错误;
D、1L 0.1 mol•L-1的Na2CO3溶液中含有溶质碳酸钠0.1mol,碳酸根离子部分水解,溶液中阴离子数目增多,所以溶液中含有的离子总物质的量大于0.3mol,离子总数大于0.3NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
 ;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.
;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
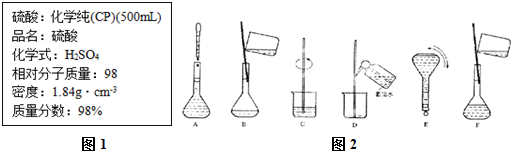
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔效应是溶液和胶体的本质区别 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
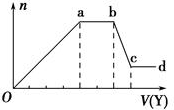 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22g CO2含有2NA个氧原子 | |
| B. | 标准状况下,22.4L的CCl4中含有的分子数为NA | |
| C. | 1mol/L的碳酸钠溶液中含Na+离子数为2NA | |
| D. | 常温下,将含0.1NA个HCl分子的氯化氢气体溶于水配成100mL溶液,所得溶液中C(H+)为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | 2HCl+Zn═ZnCl2+H2↑ | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com