
【题目】糖原和淀粉完全水解后的产物分别是( )
A. 葡萄糖 葡萄糖 B. 葡萄糖 果糖
C. 核糖 葡萄糖 D. 乳糖 果糖
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn
B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo
D. N、P、K、Cu、Fe、I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用格氏剂制取醇类,格氏试剂(RMgX)的制法是:RX+Mg ![]() RMgX(R为烃基,X为卤素)格氏试剂可发生下列转变:
RMgX(R为烃基,X为卤素)格氏试剂可发生下列转变: 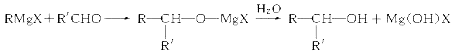
(R、R′可以是相同或不同的烃基)
以A为原料合成乙酸异丁酯( ![]() )的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
)的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
试回答: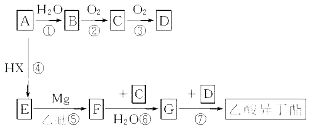
(1)上述流程中,属于或含加成反应的是(填写序号) .
(2)写出F的结构简式 .
(3)写出下列反应的化学方程式:反应① . 反应⑦ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E 为原子序数依次增大的前四周期元素。已知前四种元素的基态原子p能级都有2个单电子,E 的原子序数等于A、B、C三种元素原子序数之和。
试回答下列问题:
(1)基态E原子外围电子排布图为_________;其中M 能层有_____种能量不同的电子。
(2)从原子结构角度解释B 电负性大于D的原因是:_______________。
(3) 含A元素的化合物中,A 的原子间常有π键,但是含C元素的化合物中,C的原子间只能存在σ键,其主要原因是___________________。
(4)H2D2B8是一种具有强氧化性的二元酸(其中分子结构中有2个B原子显-1价),则H2D2B8的结构式为___________,分子中采取sp3杂化的B原子有______个。
(5)E 晶胞内粒子的堆积模型如图所示。

已知:E 晶胞的密度为ρg/cm3,NA代表阿伏加德罗常数值,E 的相对原子质量为M。
①E 粒子的配位数为_______。
②E 粒子半径为_______pm。
③E 晶胞中粒子的空间利用率φ=_____(用含π 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2 可广泛用于有机反应催化剂、污水处理剂等。实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2,请回答:
(1)识别下图中仪器。A的名称是______,B是_______
(2)实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有________的性质;实验中不能用干燥空气代替干燥N2,原因是:___________________________________________________________

(3)已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是_______。过滤必须用到的玻璃仪器是:_______。
MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是_______。过滤必须用到的玻璃仪器是:_______。
(4)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因: ______________________________
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是____________________________
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA 标准溶液滴定至终点,消耗EDTA 标准溶液26.50mL,则测得无水MgBr2产品的纯度是___________ (以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某些建筑材料会产生放射性同位素氡22286Rn,从而对人体产生危害。该同位素原子的中子数和质子数之差为( )
A.136B.50C.86D.222
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。
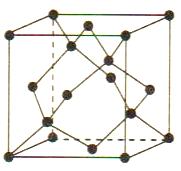
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中元素和化合物的说法,正确的是 ( )
A. 无机盐也可以为人体细胞的生命活动提供能量
B. 哺乳动物血液中钙离子含量过多会引起抽搐
C. 细胞中的无机盐大多以离子的形式存在
D. 生物体处在不同发育期,含水量基本相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com