
下列离子方程式书写正确的是( )
A.向氯化铝溶液中通入过量氨气:4NH3+Al3++2H2O===AlO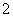 +4NH
+4NH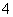
B.将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO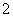 +H2↑
+H2↑
C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO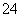 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO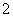 +2H2O
+2H2O
D.向NaAlO2溶液中通入足量CO2:AlO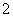 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO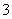
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键形成的非极性分子。根据上述事实可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不能含有氢原子
B.在ABn分子中A原子的所有价电子都参与成键
C.在ABn分子中每个共价键都相同
D.在ABn分子中A的相对原子质量应小于B的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铝单质的叙述中正确的是( )
A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长
B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属
C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层
D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
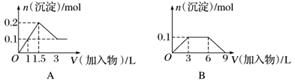
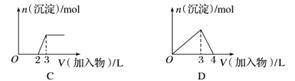
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
________________________________________________________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是__________(填化学式)。
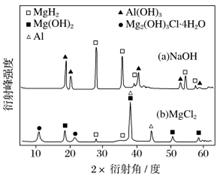
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
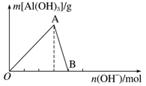
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为__________。
(2)AB段曲线所表示的反应的离子方程式为___________________________________
________________________________________________________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是___________________。
(4)向含有0.1 mol NH4Al(SO4)2溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
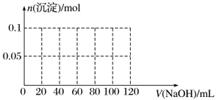
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,两个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com