
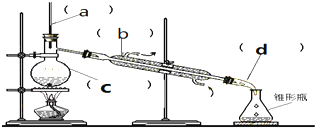
| A. | 仪器C是圆底烧瓶,加热时,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$ | |
| B. | 仪器b是直型冷凝管 | |
| C. | 仪器b中冷却水的进出方向是“下进上出” | |
| D. | 进行蒸馏操作时,温度计的下端不能放在液面以下 |
分析 蒸馏是用来分离相互溶解,沸点不同的液体,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意:温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用.
解答 解:A.仪器C是蒸馏烧瓶,加热时,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$,故A错误;
B.依据仪器B的形状可知为直型冷凝管,故B正确;
C.冷凝管应从下口进水,上口出水,故C正确;
D.蒸馏试验中温度计是测量蒸汽温度,温度计水银球应处在蒸馏烧瓶的支管口附近,故D正确;
故选:A.
点评 本题考查了蒸馏实验的基本操作及注意事项,明确蒸馏原理是解题关键,注意温度计水银球位置、冷凝水流向,为高频考点,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的相对分子质量比SiO2的相对分子质量小 | |
| B. | C-O键能小于Si-O键能 | |
| C. | C的原子半径小于Si | |
| D. | 破坏CO2晶体只需克服分子间作用力,破坏SiO2晶体要破坏Si-O共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mL | B. | 7.5mL | C. | 15mL | D. | 17.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和CO含有相同数目的原子 | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 1mol氧气中含有12.04×1023个氧原子,在常温常压下占有体积22.4L | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com