
分析 (1)NO和CO反应,生成CO2和N2,以此书写化学反应方程式;
(2)能减少或控制汽车尾气污染,则减少化石燃料的使用并开发新能源等.
解答 解(1)NO和CO反应,生成CO2和N2,该化学反应方程式为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
(2)A.制定严格的汽车尾气排放标准,并严格执行,有利于减少污染,故A正确;
B.开发清洁能源汽车,如氢能汽车.太阳能汽车等,有利于减少污染,故B正确;
C.市民出行戴防护面具,不现实,是污染后再防护的做法,不可取,故C错误;
D.市民大量移居城市郊区,不现实,大量移居成本较高,不可取,故D错误,
故答案为:AB.
点评 本题考查氮的氧化物对环境的污染及环境保护,注意能源的开发利用,学会结合信息来解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化剂只有KNO3 | B. | C发生还原反应 | C. | KNO3被氧化 | D. | S得到了电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
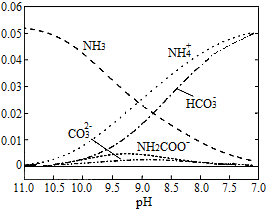 ,
,| A. | 在pH=8.0 时,c(NH4+)>c(HCO3-)>c(NH2COO-)=c(CO32-) | |
| B. | 随着C02的不断通入,Kw不变,但是水的电离受到促进 | |
| C. | 在溶液中pH不断降低的过程中,最终产物中含有NH2COO- | |
| D. | D、随着C02的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}{H}_{2}O)}$ 不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO | B. | Fe+H2SO4═FeSO4+H2↑ | ||
| C. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| B. | 中性溶液中:K+、Cl-、SO42-、Al3+ | |
| C. | 加Al粉产生H2溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
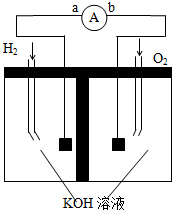 氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题
氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | CH≡CH$→_{催化剂△}^{HCl}$CH2=CHCl$→_{△}^{催化剂}$ | |
| C. | HCHO$\stackrel{O_{2}}{→}$HCOOH$→_{NaOH}^{CH_{2}OH}$HCOOCH3 | |
| D. | CH2═CH2$→_{催化剂△}^{O_{2}}$CH3CHO$→_{△}^{银氨溶液}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com