
分析 (1)根据n=$\frac{m}{M}$计算KNO3的物质的量;
(2)计算溶液总质量,根据V=$\frac{m}{ρ}$计算溶液的体积,再根据c=$\frac{n}{V}$计算物质的量浓度.
解答 解:(1)n(KNO3)=$\frac{5.05g}{101g/mol}$=0.05mol,
答:此饱和溶液中KNO3的物质的量为0.05mol;
(2)V(KNO3溶液)=$\frac{5.05g+10g}{1150g}$≈0.01L,
c(KNO3)=$\frac{0.05mol}{0.01L}$=5mol/L,
答:此饱和溶液中KNO3的物质的量浓度为5mol/L.
点评 本题考查物质的量以及溶液浓度的计算,关键是对计算公式理解,难度不大.


科目:高中化学 来源: 题型:解答题
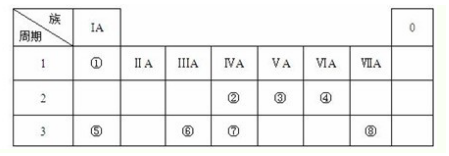
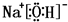 或
或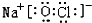 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
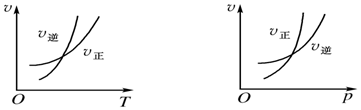
| A. | m>n,Q>0 | B. | m>n+p,Q>0 | C. | m>n,Q<0 | D. | m>n+p,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由KClO3变成KCl必须加入还原剂 | |
| B. | 向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低 | |
| C. | 已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10% | |
| D. | 一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
能用2H++ CO32- = H2O + CO2↑表示的是
A.CH3COOH和Na2CO3的反应 B.H2SO4和碳酸氢钠的反应
C.K2CO3和NaHSO4反应 D.碳酸钙和稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
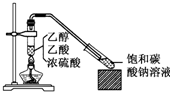 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )
实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )| A. | 制备的乙酸乙酯中混有乙酸和乙醇杂质 | |
| B. | 该实验中浓硫酸的作用是催化和吸水 | |
| C. | 饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com