
【题目】NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(1)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:

用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_____________(填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为___________________________________。
(2)可用以下方法测定处理后的废水中NaCN的含量。已知:Ⅰ.废水中NaCN 的最高排放标准为0.50mg/L;Ⅱ.Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用_________________(填仪器名称)盛装;滴定终点时的现象是____________________________。
②处理后的含NaCN 的废水是否达到排放标准____________(填“是”或“否”)。
【答案】阴极 Cl-- 2e +2OH =ClO-+H2O 5ClO-+2CN-+2OH=N2↑+2CO32-+5Cl-+H2O 酸式滴定管 滴入最后一滴硝酸银溶液,产生黄色沉淀,且半分钟内沉淀不消失 否
【解析】
(1)铁电极为活性电极,若铁为阳极,则阳极为Fe-2e-=Fe2+,而不是Cl-转化为ClO-,阳极产生的ClO-的电极反应为Cl-失电子转化为 ClO-。
(2)①AgNO3溶液显酸性,会腐蚀橡皮管;滴定终点时,生成AgI。
②处理后的含NaCN 的废水是否达标排放,可利用方程式Ag++CN-=AgCN进行计算,然后与0.50mg/L进行比较。
(1)铁电极为活性电极,若铁为阳极,则阳极为Fe-2e-=Fe2+,而不是Cl-转化为ClO-,所以铁电极为阴极;阳极产生的ClO-应来自Cl-失电子,电极反应为Cl-- 2e +2OH =ClO-+H2O,阳极产生的ClO-将CN-氧化为无害物质而除去,则生成N2、CO32-等,离子方程式为5ClO-+2CN-+2OH=N2↑+2CO32-+5Cl-+H2O。
答案为:阴极;Cl-- 2e +2OH =ClO-+H2O;5ClO-+2CN-+2OH=N2↑+2CO32-+5Cl-+H2O;
(2)①AgNO3溶液显酸性,会腐蚀橡皮管,应用酸式滴定管盛装;滴定终点时的现象是滴入最后一滴硝酸银溶液,产生黄色沉淀,且半分钟内沉淀不消失。答案为:酸式滴定管;滴入最后一滴硝酸银溶液,产生黄色沉淀,且半分钟内沉淀不消失;
②n(Ag+)=1.00×10-4mol/L×0.015L=1.5×10-6mol,由方程式Ag++CN-=AgCN,可求出
n(CN-)=1.5×10-6mol,处理后的废水中NaCN 含量为![]() =3.675mg/L>0.50mg/L,所以废水没有达到排放标准。答案为:否。
=3.675mg/L>0.50mg/L,所以废水没有达到排放标准。答案为:否。


科目:高中化学 来源: 题型:
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | I-、Cl-、H+、SO42- | NaNO3 | 6I-+2NO3-+8H+=2NO↑+4H2O+3I2 |
B | CO32-、Fe3+、Br-、SO42- | KSCN | 3SCN-+Fe3+ |
C | HClO、Na+、K+、SO32- | CaCl2 | Ca2++ SO32-=CaSO3↓ |
D | K+、Na+、HCO3-、AlO2- | HCl | H++AlO2-+H2O=Al(OH)3↓ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃料电池体积小巧、燃料使用便利、洁净环保、理论能量比高,用甲烷燃料电池为下图电解装置供电,工作一段时间后,A池中左右试管收集到的气体体积比为2:1,则:
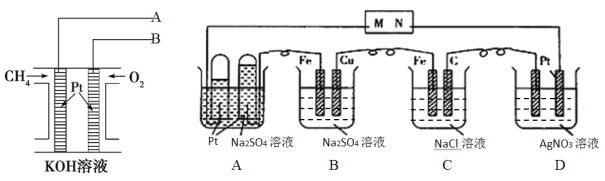
(1)电解一段时间后,甲烷燃料电池中溶液的pH_________。(填“增大、减小或不变”)
(2)甲烷燃料电池中导线A与电解池中的_________(填M或N)导线连接
(3)B池中一段时间后实验现象______________________________________________。
(4)相同条件下,电解质足量的A、B、C、D池中生成气体的总体积由大到小的顺序为_______。
(5)D池电解一段时间后,若要使电解质溶液恢复到电解前的状态,可加入________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠![]() 化合物中钠元素是
化合物中钠元素是![]() 价,NaH跟水反应放出
价,NaH跟水反应放出![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与![]() 不相同
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
A.该反应的△S<0B.正反应速率增大,逆反应速率也增大且增加的倍数更大
C.化学平衡常数K增大D.CH4的产率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
B.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
C.BaSO4和BaCO3共存的悬浊液中, 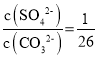
D.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com