
| A. | 达到化学平衡时,正反应速率与逆反应速率不相等 | |
| B. | 反应过程中,Y的单质的体积分数始终为50% | |
| C. | 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1 | |
| D. | 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小 |
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,则该可逆反应为氢气与氨气合成氨气的反应.
A、根据化学平衡的特征可知,达到化学平衡时,正反应速率与逆反应速率相等;
B、由题等物质的量的Y、Z两种单质反应,设均为n,根据三段式列出体积分数的式子解;
C、Y、Z以1:3的体积比转化,则达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比不能为1:1;
D、该反应质量不变,但反应中气体的物质的量减小,由M=$\frac{m}{n}$判断.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,该反应为N2+3H2$?_{催化剂}^{高温高压}$2NH3,
A、根据化学平衡的特征可知,达到化学平衡时,正反应速率与逆反应速率相等,故A错误;
B、由题等物质的量的Y、Z两种单质反应,设均为n,根据三段式:
N2 +3H2$?_{催化剂}^{高温高压}$2NH3
起始量:n n 0
转化量:x 3x 2x
某时刻:n-x n-3x 2x
则Y单质的体积分数为$\frac{n-x}{n-x+n-3x+2x}$×100%=50%,故B正确;
C、Y、Z以1:3的体积比转化,则达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比不能为1:1,故C错误;
D、由质量守恒可知,质量不变,但反应中气体的物质的量减小,则由M=$\frac{m}{V}$可知达到化学平衡的过程中气体平均相对分子质量增大,故D错误;
故答案为:B
点评 本题为综合性题,考查物质结构与性质,根据信息来推断元素是解答本题的关键,考查了化学平衡状态的判断以及化学平衡的综合运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 | |
| B. | 由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀 | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | 向等浓度的NaCl和NaI混合溶液中逐滴加入AgNO3溶液,先出现AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.
利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
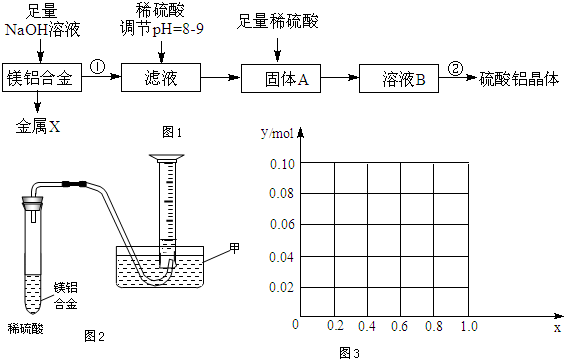
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

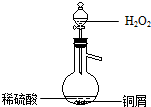 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
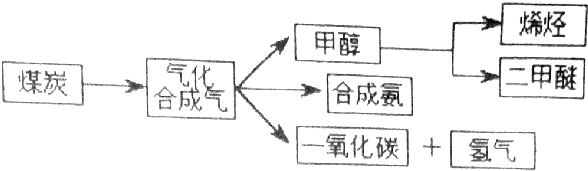
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 2:5 | D. | 5:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com