
【题目】(1)请写出实验室制备Fe(OH)3胶体的离子方程式_______________;
请写出Cl2通入到澄清石灰水中的离子方程式_______________。
(2)向Ba(OH)2溶液中通入少量二氧化碳,请写出发生反应的离子方程式_______________。
(3)写出NH4HSO4 在水溶液中的电离方程式_______________;及其与NH4HCO3 在溶液中反应的离子方程式_____________________。
(4)写出过氧化钠与水反应的离子方程式:___________________________________。
(5)已知胃酸的主要成分是盐酸,请写出用小苏打片治疗胃酸过多的离子方程式______________;
如果病人同时患有胃溃疡,此时最好服用胃舒平【主要成分为Al(OH)3】,请写出相应的的离子方程式
_____________________________________
【答案】 Fe3+ +3H2O ![]() Fe(OH)3(胶体)+3H+ Cl2+ 2OH-= Cl-+ClO-+H2O CO2+ Ba2++2OH-=BaCO3↓+2H2O NH4HSO4=NH4++H++SO42- H++HCO3-=H2O+CO2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑ HCO3-+H+=CO2↑+H2O Al(OH)3+3H+=Al3++3H2O
Fe(OH)3(胶体)+3H+ Cl2+ 2OH-= Cl-+ClO-+H2O CO2+ Ba2++2OH-=BaCO3↓+2H2O NH4HSO4=NH4++H++SO42- H++HCO3-=H2O+CO2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑ HCO3-+H+=CO2↑+H2O Al(OH)3+3H+=Al3++3H2O
【解析】(1)三价铁离子水解生成氢氧化铁胶体和氢离子,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,Cl2通入到澄清石灰水中反应生成氯化钙、次氯酸钙和水,反应的离子方程式为Cl2+ 2OH-= Cl-+ClO-+H2O,故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+,Cl2通入到澄清石灰水中反应生成氯化钙、次氯酸钙和水,反应的离子方程式为Cl2+ 2OH-= Cl-+ClO-+H2O,故答案为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;Cl2+ 2OH-= Cl-+ClO-+H2O;
Fe(OH)3(胶体)+3H+;Cl2+ 2OH-= Cl-+ClO-+H2O;
(2)向Ba(OH)2溶液中通入少量二氧化碳,反应生成碳酸钡沉淀,反应的离子方程式为CO2+ Ba2++2OH-=BaCO3↓+2H2O,故答案为:CO2+ Ba2++2OH-=BaCO3↓+2H2O;
(3)NH4HSO4在水溶液中的电离方程式为NH4HSO4=NH4++H++SO42-;其与NH4HCO3在溶液中反应生成硫酸铵和二氧化碳,反应的离子方程式为H++HCO3-=H2O+CO2↑,故答案为:NH4HSO4=NH4++H++SO42-;H++HCO3-=H2O+CO2↑;
(4)过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)小苏打为NaHCO3,胃酸中含盐酸,用小苏打治疗胃酸过多的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑,二氧化碳和水写化学式,离子反应为H++HCO3-═H2O+CO2↑,如果病人同时患有胃溃疡,此时最好服用胃舒平,盐酸与氢氧化铝反应生成氯化铝和水,离子方程式为Al(OH)3+3H+═Al3++3H2O,故答案为:H++HCO3-═H2O+CO2↑;Al(OH)3+3H+═Al3++3H2O。


科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的﹣1价离子少8个电子. 回答下列问题:
(1)元素c为;d为
(2)由这些元素形成的双原子分子为 .
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是 , 离子晶体的是 , 金属晶体的是 , 分子晶体的是;(每空填一种)
(4)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,两种化合物的电子式分别为:、 , 该反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4 , 用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480ml,需用500ml容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,向两个体积可变的密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是
A. 两种气体的密度之比是3∶2 B. 两个容器的体积之比为2∶3
C. 两种气体的分子数目相等 D. 两气体的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A. KOH的碱性比Ca(OH)2的碱性强B. 碘化氢比氟化氢稳定
C. 锂的原子失电子能力比钠弱D. 硫酸的酸性比磷酸的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5 , 实验步骤如下: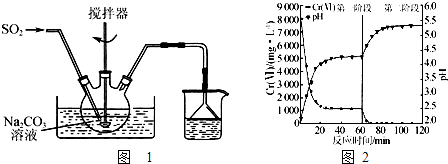
Ⅰ.在Na2CO3溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
Ⅱ.加碳酸钠粉末调至pH为7~8;
Ⅲ.再通SO2至pH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体.
(1)制备焦亚硫酸钠总反应的化学方程式为 .
(2)Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 . 步骤Ⅲ中测定溶液的pH的方法是;pH>4.1时,则产品中会有副产物,其化学式是 .
(3)利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, , 重复如上步骤2次,记录数据.(实验中必须使用的试剂有:c1molL﹣1的标准碘溶液、c2molL﹣1的标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)].利用Na2S2O5和FeSO47H2O先后分两个阶段处理含Cr2O72﹣的废水,实验结果见右图.
①实验过程中溶液的pH不断升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31 , lg2≈0.3,c(Cr3+)<1.0×10﹣5 molL﹣1时视为完全沉淀.现将废水中Cr2O72﹣全部转化为Cr(OH)3而除去,需调节溶液的pH范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中,溶质X,Y的浓度都为0.1molL﹣1 , 向混合溶液中滴加某溶液Z(0.1molL﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X,Y,Z分别是( ) 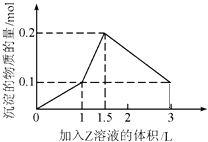
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验(填“能”或“不能”)达到目的,原因是 . 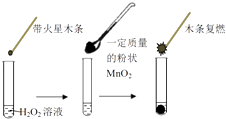
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2 , 测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 , 原因是 .
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1molL﹣1FeCl3 | 5滴0.1molL﹣1 CuCl2 | 5滴0.3molL﹣1 NaCl |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 , 实验Ⅲ的目的是 .
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是和(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com