
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
分析 A.该溶液中存在大量氢离子或氢氧根离子,SiO32-与氢离子反应;
B.四种离子之间不发生反应,都不与氢离子反应;
C.c(OH-):c(H+)=1×1012的溶液中存在大量氢氧根离子,铵根离子、钙离子与氢氧根离子反应;
D.甲基橙显黄色的溶液
解答 解:A.水电离的c( H+)=1×l0-13 mol/L的溶液为酸性或碱性溶液,SiO32-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B.K+、Fe3+、NO3-、Cl-之间不反应,都不与CH3COOH反应,在溶液中能够大量共存,故B正确;
C.c(OH-):c(H+)=1×1012的溶液中存在大量氢氧根离子,NH4+、Ca2+与氢氧根离子反应,在原子不能大量共存,故C错误;
D.甲基橙显黄色的溶液的pH大于4.4,可能为酸性或碱性溶液,CO32-、SO32-与氢离子反应,NO3-、SO32-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个 | |
| C. | 金属晶体中,铜和锌都是面心立方堆积 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生爆炸的天津滨海仓库存放的电石、氰化钠和硝酸铵等危险化学品均属于电解质 | |
| B. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| C. | 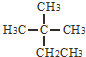 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 | |
| D. | 1mol化合物(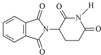 )跟足量NaOH溶液反应最多耗4molNaOH )跟足量NaOH溶液反应最多耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
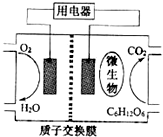
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
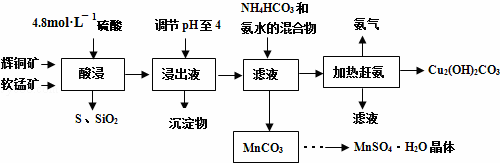
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com